Embolización de aneurismas de arteria cerebelosa superior adaptada a la anatomía del polígono de Willis.
Godes Juan E.,1,2 Maehara Raúl R.,2,3 Ré Martín S.,1,2 Petrocelli Sergio H.,1,4
1.
Hospital de Emergencias Dr. Clemente Álvarez, Rosario.
2.
Hospital Privado de Rosario, Rosario.
3.
Sanatorio Garay, Santa Fe.
4.
Sanatorio Parque, Rosario.
RESUMEN
Introducción: Los aneurismas de arteria cerebelosa superior presentan características especiales en su forma y relaciones anatómicas, frecuentemente un cuello ancho expuesto a la luz de la arteria basilar o al origen de las arterias cerebelosa superior o cerebral posterior, que representan un desafío para el tratamiento endovascular.
Objetivo: Presentar nuestra serie histórica, sus resultados y un nuevo enfoque estratégico utilizando nuevas técnicas y materiales de bajo perfil que permiten adecuar el tratamiento aprovechando las comunicaciones del polígono de Willis con el fin de lograr mejores resultados.
Materiales y métodos: Se revisaron en forma retrospectiva nuestro archivo de imágenes y serie de datos completados en forma prospectiva, desde enero de 1994 hasta julio de 2021, recogiendo datos demográficos y clínicos de 19 pacientes con 19 aneurismas de arteria cerebelosa superior, destacando características geométricas y anatómicas de cada aneurisma, resultados angiográficos inmediatos y en cada seguimiento. Se discute en forma comparativa el tratamiento realizado en cuatro de los últimos pacientes, en quienes se aplicó un nuevo enfoque estratégico basado en la anatomía del polígono de Willis.
Resultados: Sobre un total de 19 pacientes tratados (15 mujeres, 79%), 12 se presentaron con hemorragia subaracnoidea, 1 con hemorragia intracerebral, 1 con déficit de par craneal y 5 fueron incidentales. El cuello involucraba el origen de la arteria cerebelosa superior en 10 casos, y el de la cerebral posterior en 3 casos, mientras en 6 pacientes se implantaba sobre la arteria basilar. Se utilizó técnica de coiling en 12 procedimientos (11 pacientes), remodelling con balón en uno, stent y coils en cuatro, diversor de flujo en uno y p-Conus y coils en uno. El resultado inmediato fue oclusión completa en 8 pacientes, cuatro de ellos tratados con técnica de stent y coils o p-Conus y coils; remanente de cuello (Raymond-Roy 2) en 9 procedimientos y Raymond- Roy 3 en uno. Tres pacientes murieron a causa de la hemorragia primaria, dos sobrevivieron con discapacidad severa y uno con discapacidad moderada; una paciente con aneurisma incidental presentó una complicación durante el procedimiento, que fue interrumpido. No hubo rupturas intraprocedimiento ni posteriores al mismo, ni complicaciones tromboembólicas. Se obtuvo control por imágenes tras 11 procedimientos, constatando oclusión completa en 4 casos, permeabilidad grado 2 en 4 y grado 3 en 3.
Conclusiones: La embolización de aneurismas de arteria cerebelosa superior es segura y eficaz. Las características geométricas y anatómicas de estas lesiones dificultan la oclusión completa y persistente tras embolización simple con coils. El abordaje a través de comunicante posterior permite implementar técnicas de bajo perfil y lograr resultados óptimos y duraderos.
INTRODUCCIÓN
Los aneurismas de arteria cerebelosa superior (SCA) son lesiones raras, y esta localización comprende entre el 1- 2 % de todos los aneurismas intracraneanos1, 2. Dadas sus relaciones anatómicas, pueden presentarse con signos de compresión de III, IV o V nervios craneanos; sin embargo, alrededor del 60 % debutan con hemorragia subaracnoidea, frecuentemente a partir de aneurismas pequeños3, 4.
Al igual que otros aneurismas de circulación posterior, los aneurismas de SCA frecuentemente son tratados mediante abordaje endovascular. Sin embargo, los resultados con esta técnica suelen ser cuestionados por mayores tasas de remanentes permeables o recurrencia con respecto al clipado quirúrgico3, 5, 6.
Presentamos aquí nuestra casuística, detallando dificultades de la técnica, su relación con la anatomía y geometría del saco aneurismático, y alternativas de la técnica endovascular para mejorar los resultados finales.
MATERIALES Y MÉTODOS
Desde enero de 1994 hasta julio de 2021, un total de 1504 aneurismas, incluyendo 145 de territorio vértebro- basilar, fueron embolizados por los autores en diferentes instituciones y registrados prospectivamente. Entre éstos, se recogieron retrospectivamente datos de 19 pacientes con aneurismas de SCA (1.26%). Para un análisis objetivo del tratamiento fueron seleccionados sólo aneurismas saculares de arteria basilar- SCA, excluyendo los aneurismas fusiformes, de flujo, disecantes, periféricos y aquellos grandes de tronco basilar que comprometieran el origen de la arteria cerebelosa superior. Se revisaron datos clínicos, imágenes, técnica operatoria y seguimiento. Todos los procedimientos fueron realizados bajo consentimiento informado.
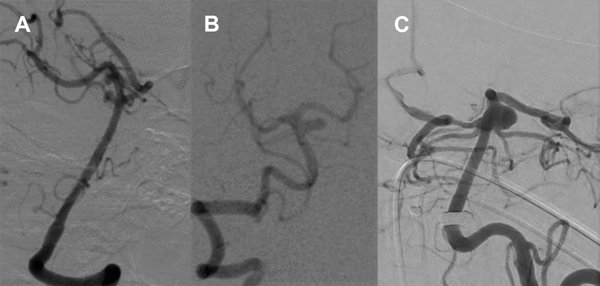
Se examinaron las imágenes clasificando los aneurismas de acuerdo al compromiso de los vasos relacionados con el cuello, describiendo así tres tipos de aneurismas: los implantados directamente en la arteria basilar (tipo BA), los que involucran el origen de SCA (tipo BA- SCA), y los que comprenden tanto el origen de cerebral posterior como el de SCA (tipo PCA- SCA), ensanchando excéntricamente el tope de la arteria basilar (figura 1).

Figura 1. Ejemplos de aneurismas tipo BA (paciente 16, caso 17), tipo BA- SCA (paciente 9, caso 10) y tipo PCA- SCA (paciente 15, caso 16).
Asimismo se determinaron las características geométricas de los aneurismas: ancho del cuello, aspect ratio (AR) y dome-to-neck ratio (DNR), para su relación con los resultados clínicos e imagenológicos.
Todos los procedimientos fueron realizados bajo anestesia general, utilizando diferentes equipos de angiografía con sustracción digital de acuerdo a cada institución. Aquellos pacientes con plan de implante de stent o diversor de flujo programado se antiagregaron con clopidogrel y aspirina durante 7 días y fueron luego evaluados con test de agregación plaquetaria en plasma rico en plaquetas (método turbidimétrico modificado, con agregómetro Chrono Log doble canal). El o los abordajes se eligieron en base a la estrategia elegida, como se detallará más adelante. Se utilizó anticoagulación sistémica completa con 10000 UI de heparina en todos los casos, una vez realizado el acceso arterial.
Los resultados angiográficos inmediatos se clasificaron de acuerdo a la escala propuesta por Raymond en: oclusión completa, cuello residual, y aneurisma residual (7). Se solicitaron estudios de control a los 3 meses en aneurismas con ruptura previa, y a los 6, 12 y 24 meses en los demás, con angio resonancia magnética nuclear con gadolinio (MRA) y/ o angiografía con sustracción digital (DSA), a fin de detectar repermeabilización.
Los resultados clínicos se evaluaron según escala de Rankin modificada.
RESULTADOS
Entre los 19 pacientes (15 mujeres, 79 %, rango de edad 26 a 73 años, promedio 52 años), uno se presentó con hemorragia intracerebral y 12 con hemorragia subaracnoidea (13 pacientes, 68 %) se presentaron y uno con hemorragia intracerebral; una paciente manifestó cefalea y paresia del III par correspondiente al lado del aneurisma. Entre los 5 aneurismas asintomáticos, cinco pacientes consultaron por cefalea inespecífica y una para control de malformación arteriovenosa frontoparietal con antecedente de hemorragia y aneurismas múltiples conocidos.
Además de esta paciente, otros seis (7 pacientes, 36.8 %) eran portadores de aneurismas múltiples. Dos se presentaron con ruptura del aneurisma de SCA, los otros fueron hallazgos incidentales (tabla 1).
De acuerdo al compromiso de los vasos relacionados en el cuello del aneurisma, hallamos: 6 aneurismas (31%) directamente implantados sobre arteria basilar (tipo BA), 10 aneurismas (52%) comprendían el origen de la arteria cerebelosa superior (tipo SCA) y 3 (15%) involucraban en el cuello los orígenes de las arterias cerebral posterior y cerebelosa superior (tipo PCA- SCA).
Todos los aneurismas resultaron menores a 15 mm, con un promedio de 6.85 mm en los sintomáticos y 4.26 mm en los incidentales. Cinco lesiones tenían cuello de 4 mm o más, 7 presentaron aspect ratio menor o igual a 1.5 y 11 dome to neck ratio menor o igual a 1.5.
Respecto al tratamiento, se realizaron 12 embolizaciones con coils, una con técnica de remodelado con balón, 4 con stent y coils, 1 con diversor de flujo y 1 con p Conus y coils. Un procedimiento fue interrumpido y diferido al quedar atrapada una microguía Mirage 0.008” en un vaso perforante, representando la única complicación de esta serie. Uno de los primeros pacientes fue intervenido por segunda vez dos años después de su embolización en agudo, por recanalización significativa, y fue la única instancia de retratamiento.
Los resultados inmediatos fueron oclusión completa (Raymond- Roy 1) en 8 pacientes (40 %); remanente de cuello en 9 pacientes (45 %) y remanente de saco permeable (Raymond- Roy 3) en un paciente (5 %). Completan la serie el pequeño aneurisma de SCA incluído en el tratamiento de un gran aneurisma de bifurcación basilar con diversor de flujo, y el aneurisma no tratado por interrumpirse el procedimiento.
Se obtuvieron estudios de control de 11 pacientes tras 12 procedimientos, con un rango de 3 meses a 22 años y un promedio de 62 meses de seguimiento (tabla 2). Los resultados observados fueron: RR 1 en 5 pacientes, RR 2 en 4 y RR 3 en 3 pacientes.
Entre los 13 pacientes con aneurismas rotos, seis (46 %) tuvieron buena recuperación clínica, 3 (23 %) discapacidad moderada o severa y otros 3 fallecieron como consecuencia de su hemorragia inicial. Seis pacientes con aneurismas no rotos tuvieron Rankin 0 al alta, y uno de ellos Rankin2.
En cuanto a complicaciones, se observó atrapamiento de una microguía Mirage 0.008” en un vaso perforante, la cual no pudo retirarse, motivando la interrupción del procedimiento. La paciente sufrió una isquemia de mesencéfalo con Rankin 2 al alta. No hubo rupturas intraoperatorias ni posteriores a la embolización, ni eventos embólicos o trombosis relacionados a los dispositivos implantados.
La mortalidad general de la serie es por tanto del 15.8% y la morbilidad 21%, mientras la morbilidad relacionada al procedimiento es del 5% y no se observaron eventos fatales.
Tabla 1. Datos demográficos y clínicos.
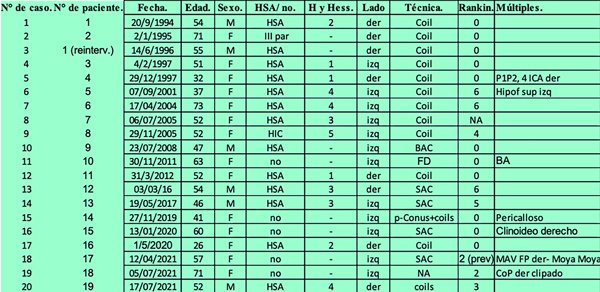
Abreviaturas: HSA: hemorragia subaracnoidea; HIC: hematoma intracerebral; SAC: stent- assisted coiling; BAC: balloon assisted coiling; FD: flow diverter; MAV: malformación arteriovenosa; NA: not available.
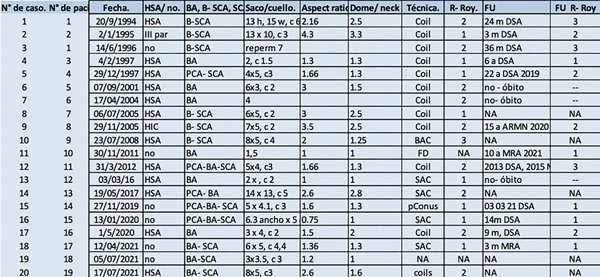
Tabla 2. Datos técnicos e imagenológicos.
DISCUSIÓN
Los reportes referidos a aneurismas de SCA son escasos, y en principio eran agrupados con otros aneurismas de la circulación posterior. Sin embargo, fueron despertando interés particular al revelarse que debutan frecuentemente con hemorragia, a menudo con un tamaño inferior al promedio, o suelen presentarse asociados a otros aneurismas, malformaciones arteriovenosas o fístulas. Pese a su íntima relación con los nervios craneanos III, IV y V, los síntomas por compresión de los mismos, que podría suponerse típica, es menos frecuente1, 2, 3, 5, 8.
De manera análoga a los demás aneurismas de circulación vértebro- basilar, se reportaron series de aneurismas de SCA sometidos a tratamiento endovascular, asumiendo esta modalidad como standard, y detallando su geometría y dificultades técnicas1, 2, 8, 9, 10 así como series comparativas de tratamientos endovascular y quirúrgico3, 5, 11.
Más recientemente se sumaron series de tratamiento quirúrgico mediante clipado, justificando este abordaje en base a las relativamente altas tasas de permeabilidad residual y repermeabilización observadas tras la terapia endovascular6.
En el presente estudio revisaremos las características anatómicas y geométricas de los aneurismas de SCA, cómo éstas tienen implicancia en los resultados angiográficos post embolización, los resultados clínicos con las diferentes modalidades terapéuticas y una propuesta para mejorar el grado y la estabilidad de la oclusión con coils a largo plazo.
En la tabla 3 se sumarizan datos de estudios dedicados a esta problemática.
Tabla 3.
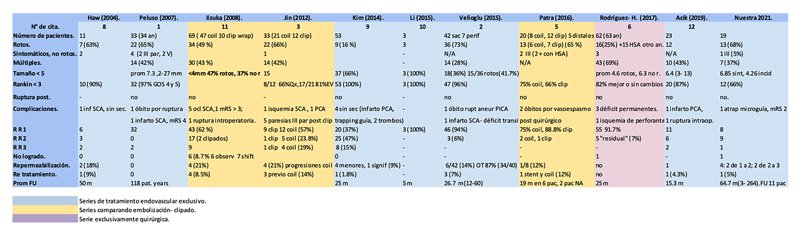
Los aneurismas de SCA son infrecuentes, y constituyen alrededor del 1.7 % de los aneurismas saculares1. Suelen ser pequeños, y en cuatro de las series revisadas consignan 73 aneurismas menores a 5 mm sobre un total de 131 (55%)2, 3, 9, 10. En nuestra serie, el tamaño osciló entre 1.5 y 15 mm, con un promedio de 6.85 mm en los sintomáticos y 4.26 mm en los incidentales. En la serie de Iizuka, 47% de los aneurismas rotos y 37% de los no rotos eran menores a 4 mm; así también en la de Rodríguez- Hernández el tamaño promedio era menor en aneurismas rotos: 4.6 vs 6.3 mm6, 11.
Respecto a la forma de presentación, pese a su relación estrecha con nervios oculomotores y el trigémino, los síntomas por compresión son infrecuentes, siendo la manifestación común la hemorragia. Entre nuestros pacientes se cuentan una hemorragia intracerebral y 12 hemorragias subaracnoideas (13/ 19, 68 %), mientras una paciente se presentó con compresión de nervio motor ocular común y cefalea, otra se diagnosticó a raíz de una hemorragia secundaria a una malformación arteriovenosa frontoparietal y los demás arribaron al diagnóstico incidentalmente. Varios estudios informan porcentajes variables pero en general altos de presentación con hemorragia a partir del aneurisma de SCA (28 a 69 %, tabla 3), aunque esto se dio en 16 de 62 pacientes en la serie de Rodríguez- Hernández, en tanto que otros 15 pacientes se diagnosticaron con hemorragia por rotura de otro aneurisma.
De hecho, este evento alerta sobre otra característica frecuentemente reportada sobre los aneurismas de SCA: entre 28 y 69% de los pacientes presentaban aneurismas múltiples; en nuestra serie, 7 de 19 pacientes (36.8 %) eran portadores de otros aneurismas.
Ante este grupo de aneurismas que, si bien infrecuentes y a menudo de pequeño tamaño, suelen ser agresivos en su manifestación clínica, la terapia endovascular se asumió como estándar, asimilándolos a los otros de territorio vértebro- basilar. Este abordaje se demostró eficaz en cuanto a la prevención de ruptura y de resangrado de aneurismas rotos, objetivo primario de toda forma de tratamiento de aneurismas. En ninguna de las series de aneurismas de SCA revisadas se describe ruptura de aneurismas embolizados, así como tampoco en los aneurismas clipados1-3, 5, 6, 8- 12. Entre nuestros pacientes, tres murieron a causa de la hemorragia inicial y dos no acudieron a control; los 14 pacientes restantes no presentaron nuevas rupturas del aneurisma embolizado.
Esta paridad en la uniforme eficacia para prevenir ruptura se pierde al comparar los resultados clínicos. Los estudios de terapia endovascular puros informan buenos resultados (Rankin <3 o GOS >3) en 87% o más de los pacientes; Jin y col. lograron buenos resultados en 81% de los pacientes embolizados y 66% de los operados, y Patra en 75% y 66%, respectivamente, en tanto Rodríguez- Hernández y col. describen en su serie quirúrgica que el 82% de los pacientes operados evolucionaron con mejoría o sin cambios (tabla 3). En general, se acepta que hay una mejor evolución clínica con significación estadística en los grupos de pacientes embolizados. De nuestros 19 pacientes, 12 tuvieron Rankin < 3, tres entre 3 y 5, tres murieron y uno fue perdido de seguimiento.
Pese a los mejores resultados en la evolución clínica, el tratamiento endovascular tiene una menor tasa de oclusión completa. En los reportes revisados, las cirugías de aneurismas de SCA arrojan resultados de clipado completo en 75% (Jin, 2012), 88.8% (Patra, 2015) y 91.7% (Rodríguez- Hernández, 2017), demostrando una evolución que implica en ocasiones el uso de técnicas complejas de by pass; asimismo informan 7-11% de aneurisma residual. En tanto, las embolizaciones, aunque eficaces en su objetivo clínico, frecuentemente dejan remanentes de cuello o aún de saco aneurismático, con tasas de oclusión completa (Raymond- Roy 1) de amplia oscilación entre 37 y 100%. Los frecuentes remanentes permeables se reflejan en la necesidad de retratamiento, presente en casi todas las series de embolizaciones (tabla 3).
En nuestra serie, el resultado inmediato ideal se obtuvo en 8 de 19 pacientes (42%), con 9 remanentes de cuello, y remanente de saco en 1 caso que fue retratado y en control posterior volvió a mostrar permeabilidad (figuras 2-4).
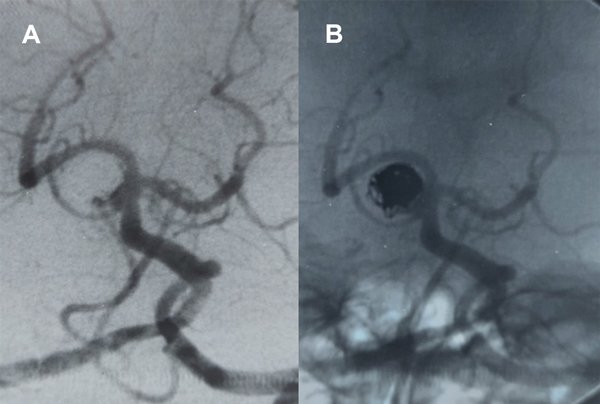
Fig. 2. Paciente 1, caso 1. Año 1994. Control a 2 meses de embolización post hemorragia subaracnoidea, cuello permeable.
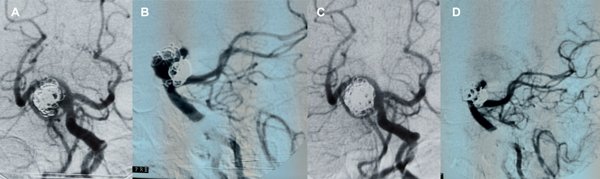
Fig. 3. Paciente 1, caso 3. Año 1996. Franca repermeabilización a 3 años (a, b), nueva embolización con coils (c, d).
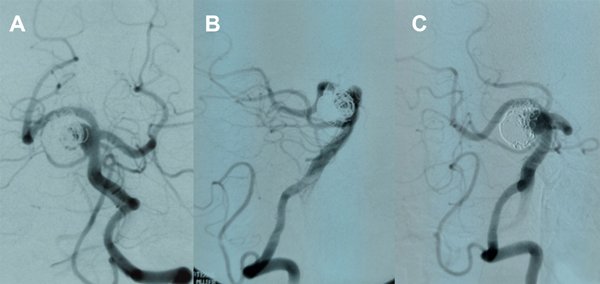
Fig. 4. Paciente 1. Control año 1999, 3 años posterior al re tratamiento, permeabilidad parcial del cuerpo del aneurisma (Raymond- Roy 3).
Este caso resulta ilustrativo de las características geométricas que suelen presentar los aneurismas de esta localización: cuello relativamente ancho, con aspect ratio (AR) y dome-to- neck ratio (DNR) desfavorables, aún en sacos de dimensión pequeña3,8,9. Brinjikji y col.13 demostraron que estas relaciones geométricas son indicadores del requerimiento de técnicas adyuvantes para lograr una embolización exitosa, y definieron el cuello “ancho” ya no como un valor absoluto, sino cuando estas tasas resultan < 1.6, y como “muy ancho” al ser < 1.2. Efectivamente, su análisis demostró que se necesitaron técnicas de embolización asistida en 80% de los aneurismas con dome-to-neck ratio<1.2 y 89% de los aneurismas con aspect ratio < 1.2, siendo este último indicador el de mayor valor predictivo. En nuestro estudio detallamos los tres parámetros geométricos esenciales, y entre nuestros 19 pacientes encontramos cinco lesiones con cuello de 4 mm o más, 7 presentaron aspect ratio menor o igual a 1.5 y 11 dome to neck ratio menor o igual a 1.5 (tabla 2).
A esta dificultad geométrica se agrega la complejidad anatómica de los aneurismas de SCA, que a menudo incluyen el origen de la arteria cerebelosa superior en el margen inferior (proximal) del cuello, exponiéndola a ser ocluida en caso de una embolización completa. El resguardo directo de la arteria cerebelosa superior es particularmente dificultosa al cursar en sentido casi opuesto respecto al tronco basilar, ya que el ángulo habitualmente agudo entre SCA y PCA se hace típicamente obtuso cuando se interpone el aneurisma, elevando el segmento P1 y descendiendo la arteria cerebelosa; en nuestra revisión hallamos sólo un ejemplo de embolización usando técnica de protección con microcatéter9. Si bien la embolización asistida con balón de remodelado se menciona en varios trabajos, su utilidad es posiblemente limitada en el contexto de un aneurisma de cuello pequeño con el origen de la arteria en el margen9.
Así encontramos que se describen oclusiones de arteria cerebelosa superior en varias series1- 3, 8, 11, llegando a tasas tan altas como 7.2% en el trabajo de Iizuka y col.11. En esta misma serie se describe un cambio de postura hacia observación en casos con compromiso de la arteria en el cuello/saco, así como un 8.7% de abordajes que no concluyeron en embolización. Aunque varios autores citan que la oclusión de SCA es bien tolerada, esta afirmación se basa en parte sobre reportes de oclusiones periféricas2, 3, 10, 14- 16 que no son objeto del presente estudio. Rhoton describe la presencia de un promedio de 2 a 5 ramas perforantes en el segmento proximal de la arteria cerebelosa superior, con variabilidad de 0 a 1017. Los estudios revisados detallan nueve infartos de territorio de SCA post embolización, con buena recuperación clínica en 7 y secuela significativa en 2.
Nuestro enfoque terapéutico siempre fue conservador respecto al vaso portador y ramas relacionadas, cumpliendo con el objetivo de prevenir ruptura y lograr el mejor resultado clínico posible. Sin embargo, coincidimos con Acik y col.12 en que las técnicas más novedosas fueron subutilizadas en varios reportes, predominando la embolización primaria con coils, así también en nuestros primeros pacientes, en quienes un remanente de cuello es común, con objeto de preservar la permeabilidad de la SCA.
A continuación se presentan 4 casos de aneurismas no rotos, con geometría desfavorable y compromiso del origen de la SCA, abordados en forma combinada para lograr oclusión completa.
Caso 1
Paciente mujer de 41 años, hipertensa severa en tratamiento combinado, consulta por cefalea y se diagnostican incidentalmente un aneurisma de pericallosa derecha de 2 mm y otro de SCA izquierda de 5 x 4.1 mm, cuello de 3 mm (AR 1.6, NDR 1.3). Luego de realizar coiling del aneurisma de pericallosa, en una segunda sesión, con la paciente antiagregada, se toma un doble abordaje femoral bajo anestesia general.
Bajo anticoagulación con 10000 UI de heparina se abordan las arterias carótida interna derecha y vertebral izquierda con catéteres guía 6F y 5F respectivamente.
Con un microcatéter Excelsior SL 10 sobre microguía Transend 0.014” se navega el sifón carotídeo derecho, la arteria comunicante posterior, el segmento P1 de la PCA derecha y el tronco basilar en sentido retrógrado, bajo road mapping.
Tras intercambiar sobre microguía Transend 0.014” de 300 cm por un microcatéter Prowler Select Plus, se posiciona éste en el aneurisma, cuyo cuello está orientado en línea recta frente al segmento P1 derecho. Esto permitió desplegar un pConus con corona de 5 mm (PCON2 4-15-5, Phenox, Alemania), tras lo cual se vuelve a ascender por la misma ruta con el Excelsior SL 10 hasta el aneurisma para implantar sucesivos microcoils, logrando una oclusión completa y respetando los vasos relacionados. La MRA a 7 meses y DSA a 16 meses constatan oclusión completa y persistente, con la paciente asintomática, actualmente bajo aspirina (Figura 5).
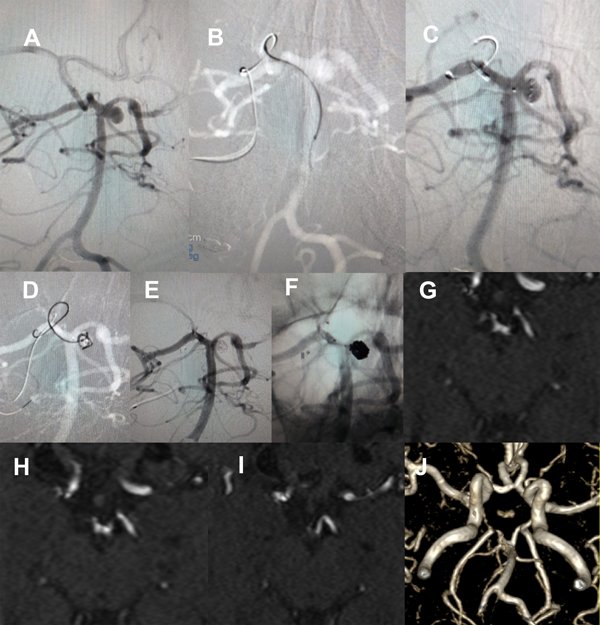
Figura 5. Paciente 14, caso 15. A, DSA preembolización, Vertebral izquierda OAD, se visualizan aneurisma SCA izq tipo PCA- SCA y polígono de Willis. B- D, abordaje a arteria basilar, implante pConus, coil. E- F, DSA post embolización, R-R 1; G- J, MRA control a los 7 meses.
Caso 2.
Paciente mujer de 60 años con diagnóstico incidental de aneurismas múltiples, con un aneurisma de mayor tamaño de forma ampular sobre el tronco basilar, en el segmento de cerebelosa superior izquierda, cuyo diámetro es de 6.3 de ancho y 5 mm de altura con cuello de 6.6 mm (AR 0.75, DNR 1), orientado hacia afuera y que eleva el origen de la arteria cerebral posterior izquierda e involucra el origen de la arteria cerebelosa superior izquierda.
Se tomó un doble abordaje con vaina carotídea Shuttle 7F que se posiciona en segmento ascendente de la arteria subclavia izquierda y catéter Guider 6F a segmento suprabulbar de carótida interna derecha. Por este último se navega un microcatéter Excelsior SL10 sobre guía Transend 0.014”, avanzando por la arteria comunicante posterior que es de buen tamaño hacia el segmentoP1 derecho en forma retrógrada y luego se utiliza una guía Hybrid 0.007” para avanzar selectivamente en la arteria cerebelosa superior izquierda.
Dejando este microcatéter posicionado, se asciende con otro microcatéter SL10 por arteria vertebral izquierda y tronco basilar hasta la cavidad aneurismática, y se asegura la posición insinuando un asa de coil.
En paralelo por el mismo acceso se progresa un tercer microcatéter, en este caso Headway21, avanzado hasta segmento P2 de la arteria cerebral posterior izquierda.
A través del SL10 ubicado en arteria cerebelosa superior izquierda se implanta un stent de malla semi abierta Neuroform Atlas 3 x 15mm, cruzando el tronco basilar hacia el segmento P1 derecho, logrando correcta expansión y con controles satisfactorios en ambas arterias.
Como segundo paso, a través del microcatéter Headway21 se implanta un stent autoexpandible de malla cerrada Lvis de 3.5 x 17mm, descendiendo desde cerebral posterior izquierda por el tronco basilar con buena expansión sobre el mismo y cubriendo toda la extensión del cuello del aneurisma.
Por último, a través del SL10 posicionado en la cavidad aneurismática se inicia la embolización implantando sucesivos microcoils de platino hasta lograr un ovillo compacto que ocupa toda la malformación.
La series angiográfícas de control muestran adecuada oclusión del aneurisma y buena perfusión en todos los territorios, prestando especial atención a las ramas involucradas en el implante de stents. La paciente se mantiene asintomática, actualmente antiagregada sólo con aspirina, y la DSA a 14 meses confirma oclusión completa (RR 1) (figura 6).
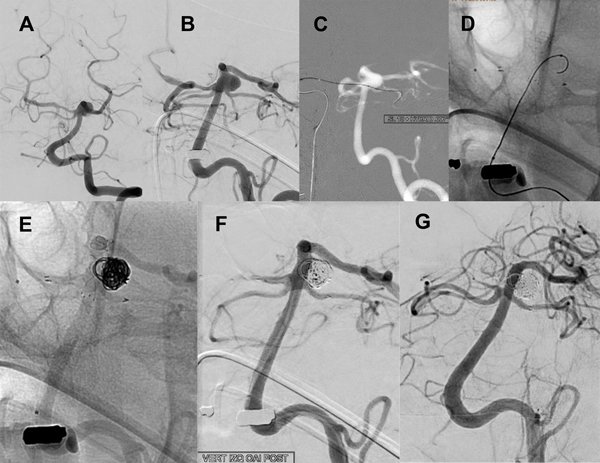
Figura 6. Paciente 15, caso 16. A y B, DSA pre embolización, aneurisma de SCA izquierda tipo PCA- SCA; C, abordaje de SCA izquierda desde PComA- P1 derecha; D, inicio de coiling tras implantar Neuroform Atlas 3 x 21 y Lvis 3.5 x 17; E- F, DSA post embolización, R-R 1; G, control a los 13 meses.
Caso 3.
Paciente mujer de 57 años, antecedente alejado de hemorragia intracerebral frontal derecha por ruptura de malformación arteriovenosa frontoparietal, embolizada en otro servicio y posteriormente irradiada, con oclusión parcial. Enfermedad tipo Moya Moya en territorio carotídeo derecho. Grado funcional 2 en escala de Rankin modificada. Aneurisma de cerebelosa superior izquierda con saco de 6 x 5 mm, cuello de 4.4 mm (AR 1.36, DNR 1.3) que incluye los orígenes de PCA y SCA. En consenso con la paciente y familiar se decide su tratamiento.
Con la paciente bajo antiagregación se abordan ambas arterias femorales bajo anestesia general. Tras administrar 10000 UI de heparina endovenosa, se posicionan un catéter Guider 5F en vertebral izquierda y un Guider 6F en carótida izquierda.
Desde este último se navega un microcatéter Excelsior SL 10 con extremo preformado al vapor sobre microguía Transend 0.014”, ascendiendo al sifón carotídeo hasta la comunicante posterior, con road mapping de este territorio en proyección lateral.
A continuación se utiliza road mapping de territorio vértebro- basilar en proyección anteroposterior para guiar el microcatéter sobre una microguía Hybrid 0.007” desde el segmento P1 izquierdo hacia la arteria cerebelosa superior izquierda.
Desde vertebral izquierda se accede con otro microcatéter Excelsior SL 10 con extremo preformado al vapor, hasta ubicar su extremo en la cavidad aneurismática.
Desde el primer microcatéter se implanta un stent de malla semiabierta Neuroform Atlas 3.0 x 21 mm entre la cerebelosa superior izquierda hasta el segmento P1 izquierdo, describiendo una “C” que cubre el cuello del aneurisma y protege el origen de la arteria cerebelosa, y a continuación se implantan microcoils desde el microcatéter “jailed” hasta lograr una oclusión completa, sin observarse alteraciones en la circulación cerebral.
La paciente se mantiene estable, bajo doble antiagregación, y la MRA a 3 meses confirma oclusión persistente (figura 7).
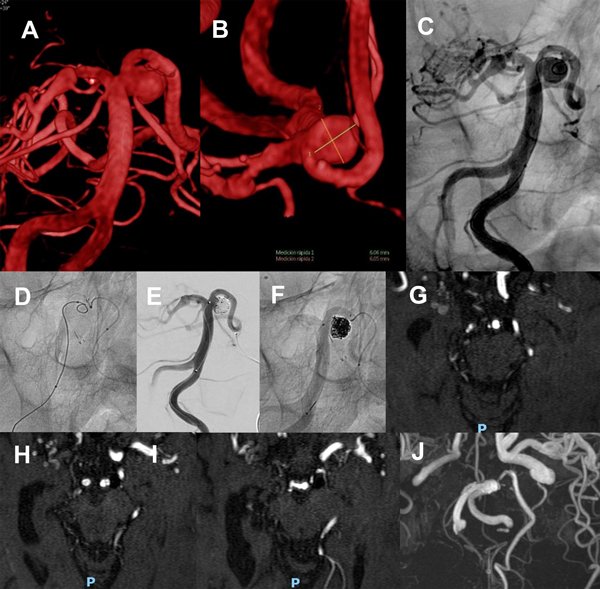
Figura 7. Paciente 17, caso 18. A- C, DSA mostrando aneurisma tipo BA- SCA izquierdo. D, inicio de coiling tras implantar Neuroform Atlas desde PComA- P1 izquierda a SCA izquierda. E- F, post embolización, RR 1. G- J, MRA control a los 3 meses.
Caso 4.
Mujer de 71 años con historia de hipertensión arterial y aneurismas cerebrales múltiples, tratamiento quirúrgico de aneurisma de comunicante posterior derecho dos meses atrás. Convulsiones tratadas con Levetiracetam. En acuerdo con Neurocirugía se propone tratamiento endovascular de un aneurisma de cerebelosa superior izquierda.
Con la paciente bajo anestesia general y desde punción femoral bilateral se colocan introductores 6 y 5F. Se realizan angiografías preembolización desde vertebral derecha dominante demostrando un tope basilar algo displásico. Entre la cerebral posterior y la cerebelosa izquierdas se observa un aneurisma redondeado algo irregular de 3 x 3.5 mm, cuello 3 mm (AR 1.2, DNR 1) desde cuyo margen inferior (proximal) tiene origen la arteria cerebelosa superior. Las cerebrales posteriores están permeables y es visible la comunicante posterior izquierda por inyección desde carótida izquierda.
Se colocan entonces catéteres guías 5F en vertebral derecha y 6F en carótida interna izquierda, planeando un doble abordaje similar al caso 3 presentado arriba, con stenting desde SCA izquierda a segmento P1 izquierdo y microcatéter “jailed” para implantar coils.
Se navega el sifón carotídeo izquierdo y la comunicante posterior y desde ésta en forma retrógrada por cerebral posterior izquierda hacia P1 y tronco basilar utilizando microcatéter SL10 y microguías primero Transend 14 y luego Mirage 0.008” para navegación más delicada, procurando llevarlo a la SCA para implantar un stent Neuroform Atlas.
El SL10 requiere reposicionamiento ya que el tope basilar dilatado dificulta el cateterismo selectivo de la arteria cerebelosa superior izquierda. Para ello se utiliza además de la guía Mirage el agregado de un microbalón Hyperform desde vertebral derecha que es inflado parcialmente en el tope basilar, para formar una contención lateral que permita al cateterismo selectivo de la arteria cerebelosa.
En estas maniobras de reposicionamiento y abordaje con la microguía hacia el origen de la arteria cerebelosa, se nota en un momento la limitación de movimiento del extremo distal de la microguía que no permite retirarla, observando una posición fija del extremo distal de la guía. Ante esta situación inusual se realiza una XperCT que muestra el extremo de la microguía externo y posterior a la silueta de la arteria basilar, sin observar signos de disección; en cambio, impresiona que el extremo de la microguía se insinúa en una rama perforante muy delgada.
A pesar de las instilaciones de vasodilatadores desde catéter y microcatéter, la microguía permanece atrapada y no se logra retirar tras unas dos horas de intervención, por lo que se decide dejarla emplazada en el lugar retirando el microcatéter. Los controles angiográficos muestran sólo irregularidad a nivel del segmento P1 izquierdo e indemnidad del resto de los vasos. La tomografía computada realizada con el angiógrafo descarta extravasación.
La paciente se recupera de la anestesia somnolienta, movilizando los cuatro miembros y con respuesta verbal y se traslada a Cuidados Intensivos. Controles posteriores con TAC helicoidal no demostraron infarto (figura 8).
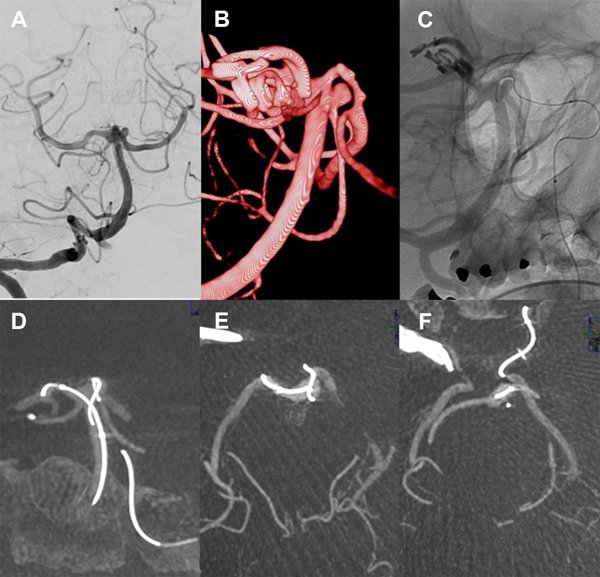
Figura 8. Paciente 18, caso 19. A, B: proyecciones AP y OAD de angiografía convencional y 3D, mostrando un aneurisma tipo BA- SCA izquierdo; C: Fluoroscopía en OAD, abordaje desde PComA izquierda procurando llegar a SCA izquierda para implante de stent; D: proyección similar en XperCT; E-F: proyección axial de XperCT comprobando situación de microguía fuera de la silueta de arteria basilar, atrapada en vaso perforante.
Nuestra serie reúne pacientes desde la primera época de la terapia endovascular; es natural que nuevos recursos técnicos se empleen en su tratamiento. Así también debería observarse en las demás publicaciones. No obstante, es notablemente baja la frecuencia de uso de stents hasta el reciente reporte de Acik y col.12; en cambio se usaron otras técnicas de protección, como remodelado con balón, hasta 42.8% de los casos en la serie de Velioglu2. Una explicación posible sería la baja expectativa de lograr mayor compactación de coils sin ocluir la SCA9. Esto también justifica la técnica “post jailing” en 2 de los casos presentados por Li y col10.
Los aneurismas de SCA anatómicamente pertenecen al grupo de aneurismas de pared lateral; sin embargo, como observaron otros autores, se comportan en cierta forma como aneurismas de bifurcación entre la PCA y la SCA11. Esto es más evidente si se abordan desde el tope de la arteria basilar, a través de la arteria comunicante posterior, dado el mencionado cambio de angulación entre PCA y SCA impuesto por el aneurisma. Desde esta perspectiva, el acceso a la SCA es más rectilíneo y evita enfrentar la curvatura cerrada que impone el acceso desde arteria basilar.
De igual manera, el propio aneurisma queda directamente expuesto al segmento P1 contralateral, lo cual nos facilitó emplazar un microcatéter 0.021”y desplegar el pConus; podría especularse de la misma forma el implante de un diversor de flujo intrasacular. El tronco basilar y la arteria vertebral ofrecen un segmento amplio para realizar maniobras de intercambio, favoreciendo un abordaje inicial de bajo perfil. Hasta donde sabemos, este es el primer reporte en presentar el uso sistemático de este método, el cual consideramos decisivo para lograr buenos resultados en el tratamiento de aneurismas con geometría muy desfavorable y compromiso de vasos relacionados.
Utilizando esta técnica hemos sufrido el atrapamiento de una microguía de 0,008”, complicación seria y rara, única en nuestra serie general. Este evento tuvo morbilidad significativa, con síntomas cerebelosos y oftalmoparesia actualmente en recuperación, aunque fue muy reciente y aún no podemos objetivar la secuela clínica. Tal complicación técnica fue descripta anteriormente durante el abordaje a un aneurisma de SCA18 y a otro de circulación anterior19, debiendo considerarse al planificar la estrategia.
Es atractivo planear el tratamiento de estos aneurismas mediante implante de un diversor de flujo (FD), dada su factibilidad y la alta tasa de oclusión en aneurismas de pared lateral, sin considerar su localización. El único caso en que implantamos un FD en esta serie fue para tratamiento de un aneurisma grande de bifurcación basilar, y fue exitoso, logrando oclusión de ambas lesiones. Los metaanálisis sobre uso de FD en circulación posterior informan porcentajes de oclusión angiográfica variables (65- 84%), pero suelen incluir aneurismas gigantes, fusiformes o disecantes (20, 21), con muy pocos casos de aneurismas SCA21. En un estudio donde sólo se incluyeron aneurismas saculares de sector posterior (n= 54) tratados con un FD específico, se obtuvo oclusión en 82.9%22. Acik y col usaron 2 FD en su serie, con oclusión completa de una lesión y resultado Raymond- Roy 2 en otra. El autor aclara que usó esta técnica en aneurismas considerados malos candidatos para coiling12.
Nuestro uso discreto de este método en circulación posterior obedece a evitar el efecto diversor sobre las importantes ramas de este segmento, incluyendo las numerosas perforantes. En un estudio monocéntrico sobre 413 pacientes tratados con FD, 18% presentaron algún tipo de complicación neurológica, 61% de tipo isquémico 23. Tras análisis uni y multivariado, uno de los factores asociados a este riesgo era la localización en circulación posterior. Hellstern y col. informa sobre 2 complicaciones intraoperatorias sobre 54 casos de aneurismas saculares de sector posterior (14 de ellos de SCA, 25%) tratados con FD, además de 5 dentro de los 30 días posteriores, una de ellas fatal, y una más tardía, totalizando una morbimortalidad del 14.8%. La tasa total de isquemias fue de 9.3%, y los autores lo atribuyen a la densidad de arterias perforantes, comparando con el 4.8% de este tipo de complicación en tratamientos de aneurismas de circulación anterior22.
Al ser el tope de la basilar un sitio con numerosas ramas, no es raro que ocurran también oclusiones asintomáticas tras implantar un FD; en el estudio mencionado citan 2 casos (3.8%). Como ocurre en aneurismas silvianos tratados con FD, la oclusión asintomática de una rama delgada suele ser requerimiento para lograr la oclusión del aneurisma; esto depende de la existencia de una buena circulación anastomótica, variable independiente y difícil de predecir24. En el estudio citado se ilustra un caso de persistencia de un aneurisma pequeño que involucra el origen de SCA, tras implante exitoso de dos FD en procedimientos separados21.
Nuestro estudio está limitado por presentar un bajo número de pacientes tratados con un nuevo abordaje, que requiere ser validado tanto en eficacia como en seguridad, así como amerita ser comparado con otras técnicas poco utilizadas, como el implante de diversores de flujo.
CONCLUSIONES
Al planear la estrategia de tratamiento de un aneurisma de SCA es importante evaluar el polígono de Willis, ya que la permeabilidad de una arteria comunicante posterior con diámetro suficiente suma una potencial vía de abordaje, permitiendo el uso de dispositivos necesarios para la embolización de aneurismas de cuello ancho y protegiendo los vasos relacionados.
La continua evolución de técnicas y dispositivos para tratamiento endovascular aumenta la capacidad para ocluir en forma duradera aneurismas de difícil manejo convencional. Estos métodos requieren validación a través de estudios más extendidos.
REFERENCIAS