Abordaje quirúrgico del hematoma subdural crónico: revisión de la fisiopatología y experiencia en nuestro centro
Hugo Romero Vinet,1 Edoardo Horlacher,1 Carlos Bennett Colomer2
1. Universidad de Valparaíso, Valparaíso, Chile
2. Hospital Carlos Van Buren, Valparaíso, Chile
Recibido: 08/05/2025 Aceptado: 15/08/2025
Hugo Romero Vinet
Correo electrónico: hugo.romero.vinet@gmail.comLos autores no declaran conflicto de interés
Los autores no declaran financiamiento.
Este es un artículo de acceso abierto bajo la licencia CC BY-NC https://creativecommons.org/licenses/by-nc/4.0/
RESUMEN
Introducción: el hematoma subdural crónico (HSDc) es una entidad neuroquirúrgica frecuente en adultos mayores, caracterizada por una inflamación persistente de una neomembrana con neovascularización frágil y episodios de microhemorragia recurrente. A pesar del manejo quirúrgico estándar mediante trepanación y drenaje subdural, las tasas de recurrencia sintomática continúan siendo elevadas, alcanzando hasta un 20% en algunas series.
Objetivos: evaluar la eficacia clínica y las tasas de recurrencia asociadas al uso de un drenaje subperióstico con un amplio bolsillo subgaleal en pacientes intervenidos por HSDc en un centro terciario.
Materiales y métodos: estudio retrospectivo que incluyó a 213 pacientes adultos sometidos a evacuación de HSDc mediante trépano y drenaje subperióstico. Se analizaron variables clínicas, quirúrgicas y de seguimiento en el corto y mediano plazo.
Resultados: la edad promedio fue de 69.6 años; el 67.4% eran hombres. El síntoma más frecuente fue déficit motor (73.71%), seguido por alteración del sensorio (52.58%). Se utilizó un solo trépano en el 81.22% de los casos. El retiro del drenaje se realizó dentro de las primeras 48 horas en el 89.11% de los pacientes. La tasa de recurrencia sintomática que requirió reintervención fue del 3.37%, marcadamente inferior a la reportada en series tradicionales con drenajes subdurales.
Conclusiones: el uso de drenaje subperióstico con un amplio bolsillo subgaleal mostró excelentes resultados clínicos: baja tasa de recurrencias, recuperación rápida y mínimas complicaciones. La técnica demostró ser eficaz, incluso en pacientes con comorbilidades y en tratamiento anticoagulante.
Palabras clave: Drenaje subdural. Drenaje subperiostal. Hematoma subdural crónico. Subdural
Surgical approach to chronic subdural hematoma: review of pathophysiology and experience at our center
ABSTRACT
Background: chronic subdural hematoma (cSDH) is a common neurosurgical entity in older adults, characterized by persistent inflammation of a neomembrane with fragile neovascularization and episodes of recurrent microhemorrhage. Despite standard surgical management using burr hole and subdural drainage, symptomatic recurrence rates remain high, reaching up to 20% in some series.
Objectives: to evaluate clinical efficacy and recurrence rates associated with a subperiosteal drain with a wide subgaleal pocket in patients undergoing surgery for cSDH at a tertiary center.
Methods: this was a retrospective study including 213 adult patients who underwent evacuation of cSDH using burr hole and subperiosteal drainage. Clinical, surgical, and short- and medium-term follow-up variables were analyzed.
Results: the mean age was 69.6 years; 67.4% were men. The most common symptom was motor deficit (73.71%), followed by sensory disturbance (52.58%). A single trephine was used in 81.22% of cases. Drain removal was performed within the first 48 hours in 89.11% of patients. The rate of symptomatic recurrence requiring reintervention was 3.37%, markedly lower than that reported in traditional series with subdural drains.
Conclusions: a subperiosteal drainage with a wide subgaleal pocket showed excellent clinical results: low recurrence rate, rapid recovery, and minimal complications. The technique proved effective even in patients with comorbidities and on anticoagulant therapy.
Keywords: Chronic subdural hematoma. Subdural. Subdural drainage. Subperiosteal drainage
INTRODUCCIÓN
El hematoma subdural crónico (HSDc) es una de las patologías más frecuentes en neurocirugía, caracterizada por la acumulación anormal de sangre, producto de la degradación de hemáticos y fluidos entre una delgada capa ubicada entre la duramadre y la aracnoides.(1,2)
La incidencia global del HSDc es de 1.72 a 20.6 por 100000 habitantes/año, y alcanza una incidencia de hasta 58 por 100000 habitantes/año en la población mayor de 65 años.(3-5) Además, se ha observado una clara predilección por el sexo masculino, con una relación de 3:1.(6) Dado el envejecimiento poblacional y el aumento en el uso de fármacos antiplaquetarios y anticoagulantes, se espera que la incidencia del HSDc sea cada vez mayor.(2)
La fisiopatología del HSDc se ha atribuido tradicionalmente al trauma y la rotura de venas puentes, en su paso desde el espacio subaracnoideo a la capa interna de la duramadre. Lo que inicialmente sería un hematoma subdural agudo, producto de la degradación de la sangre, pasaría a conformar el HSDc, sin embargo, esta explicación ha sido cuestionada en los últimos años.(1,2,7)
El manejo del HSDc sintomático es fundamentalmente quirúrgico, mientras que el abordaje conservador, que puede incluir observación o terapias adyuvantes como corticoides y atorvastatina, es una opción viable en pacientes asintomáticos y con hematomas de pequeño tamaño.(1,2,6,8) Las opciones quirúrgicas incluyen la evacuación vía burr-hole, pin-hole con drenaje cerrado y por craneotomía.(2,6) La evacuación vía burr-hole es la técnica más utilizada, y ha demostrado ser efectiva, con una mejor tasa de beneficios en relación con las complicaciones.(9-11) Recientemente, se ha observado interés en el manejo endovascular del HSDc mediante la embolización de la arteria meníngea media (AMM), como monoterapia en pacientes asintomáticos o como tratamiento adyuvante a la cirugía en pacientes sintomáticos.(4,12-14)
Una de las principales complicaciones del tratamiento del HSDc es la recurrencia, dado que, principalmente, requiere reintervención quirúrgica. Se estima que entre un 10 a 20% de los pacientes precisa una nueva cirugía por recidiva sintomática.(2,6,15) Para reducir la recurrencia, se han propuesto diferentes estrategias, como el lavado con solución salina, el uso de drenajes subdurales y la embolización de la AMM como tratamiento adyuvante a la cirugía.(9,14,16-17)
En nuestro centro, hemos realizado dos modificaciones a la tríada clásica de manejo del HSDc (evacuación por burr-hole, irrigación con solución salina e instalación de drenaje subdural), que consiste en la confección de un amplio bolsillo subperióstico. Entendemos que este no ha sido descripto previamente, junto con el uso de un drenaje subperióstico.
OBJETIVOS
Realizar una revisión de la fisiopatología del HSDc y describir nuestra técnica quirúrgica y evaluar la tasa de recidivas y complicaciones.
MATERIALES Y MÉTODOS
Estudio retrospectivo en pacientes adultos que fueron operados de HSDc unilateral o bilateral en nuestra institución, entre marzo de 2020 y diciembre de 2024.
Criterios de inclusión
● Pacientes adultos con HSDc de la convexidad.
● Pacientes operados vía burr-hole (uno o dos por lado).
● Confección de bolsillo subperióstico e instalación de drenaje subperiostal.
Criterios de exclusión
● Pacientes pediátricos (<18 años).
● Pacientes con HSDc de la base del cráneo o interhemisféricos.
● Pacientes con HSDc trabeculares.
● Pacientes con diagnóstico de ingreso diferente a HSDc (por ejemplo, postquirúrgico o desarrollado durante la hospitalización).
● Pacientes sin seguimiento postoperatorio en nuestro centro.
Metodología
Se revisaron las fichas clínicas y protocolos operatorios de todos los pacientes ingresados a nuestro centro con el diagnóstico de HSDc. Se registraron las siguientes variables:
● Edad y sexo.
● Comorbilidades asociadas y trastornos de la coagulación (uso de antiagregantes plaquetarios, anticoagulantes o patologías de la coagulación).
● Lateralidad del hematoma.
● Síntomas de presentación y Glasgow de ingreso.
● Técnica quirúrgica utilizada (uno o dos orificios de trépano).
● Horas desde la cirugía hasta el retiro del drenaje (<24 horas, 24-48 horas o >48 horas).
● Tiempo de estadía intrahospitalaria.
● Resolución sintomática al alta por la especialidad (sí, no, parcial).
● Recidiva sintomática (sí o no).
● Complicaciones postoperatorias.
Se definieron recidivas sintomáticas como aquellos pacientes que consultaron nuevamente, luego de una cirugía de evacuación, por síntomas secundarios a un HSDc recidivado, con efecto de masa y que haya requerido cirugía para su resolución.
Análisis interno
A modo de análisis interno evaluamos nuestro tiempo de espera desde el ingreso a la cirugía, y comparamos los resultados quirúrgicos entre la realización de 1 o 2 orificios de trépano, que fue la principal variabilidad en la técnica quirúrgica entre los cirujanos de nuestro centro.
Técnica quirúrgica
La técnica quirúrgica realizada en nuestro centro consiste en la evacuación del HSDc vía 1 o 2 orificios de trépano, con lavado de la cavidad del hematoma con solución salina, confección de un amplio bolsillo subperióstico y colocación de un drenaje subperiostal.
Selección del paciente
Esta técnica se realiza en pacientes adultos con diagnóstico de HSDc, sea unilateral o bilateral, y sintomático o con efecto de masa a la tomografía.
Según el resultado tomográfico, de acuerdo con la clasificación de Nakaguchi, los HSDc pueden ser tipificados en 4 tipos: homogéneos, laminares, separados y trabeculares.(18,19) Nuestra técnica se utiliza en HSDc homogéneos, laminares y separados, mientras que los trabeculares suelen requerir evacuación por craneotomía.
Planificación
Todos los pacientes cuentan con una tomografía de encéfalo prequirúrgica para confirmar el diagnóstico y planificar el abordaje. Mediante la reconstrucción en 3 planos de la tomografía (axial, coronal y sagital), se identifica el punto de mayor diámetro del hematoma, que será el punto de abordaje en aquellos casos donde se utilice 1 solo orificio de trépano, y el punto medio en caso de realizar 2 orificios de trépano. La decisión de hacer 1 o 2 orificios no está estandarizada en nuestro centro y queda a discreción del cirujano tratante.
Anestesia
La mayoría de nuestros pacientes se opera bajo anestesia general, mientras que aquellos con buen nivel de conciencia y cooperadores son candidatos a sedación. Esta decisión queda a discreción del anestesista.
Posicionamiento
El paciente se posiciona en decúbito supino con la cabeza ligeramente flectada sobre una herradura. En casos de HSDc unilaterales, la cabeza se rota hacia el lado contralateral al hematoma, mientras que en casos de HSDc bilaterales, se mantiene en posición neutra.
Técnica quirúrgica
Tras el posicionamiento, se realiza una tricotomía amplia para formar un campo quirúrgico que permita sacar el drenaje por contrabertura a, al menos, 5 cm de la incisión.
Procedimiento general:
1. Localización del hematoma mediante planificación tomográfica y puntos craneométricos.
2. Apertura de piel en 1 o 2 incisiones de aproximadamente 5 cm cada una, según si se realizará 1 o 2 orificios de trépano. La piel se abre hasta el hueso.
3. Confección de un bolsillo subperiostal amplio y circunferencial a la incisión.
4. Realización de un orificio de al menos 1.5 cm de diámetro por incisión, utilizando motor y fresa.
5. Coagulación de duramadre y apertura de forma cruciforme para exponer la cápsula parietal del hematoma.
6. Coagulación de la cápsula parietal con bipolar y apertura puntiforme.
7. Evacuación pasiva del contenido hemático subdural hasta que disminuya su presión de salida.
8. Una vez que el contenido hemático deja de salir a presión, se amplía la capsulotomía con uso de bipolar.
9. Lavado de la cavidad del hematoma son jeringa de 60 ml y solución fisiológica de forma circunferencial (en 360°) hasta obtención de líquido claro.
10. Coagulación de restos de dura y cápsula parietal hasta los bordes del orificio.
11. Posicionamiento de un drenaje siliconado en el bolsillo subperiostal y salida por contrabertura a 5 cm de la incisión como mínimo.
12. Cierre de la incisión por planos.
13. Una vez finalizada la intervención, se realiza una curación plana de la (o las) herida(s), evitando el uso de un vendaje compresivo para no cerrar el bolsillo subperiostal.
Técnica de 1 orificio de trépano: la incisión se realiza en el punto de mayor espesor del hematoma subdural. Después de abrir la cápsula parietal, y una vez que el contenido deja de salir a presión, es fundamental realizar el lavado con solución fisiológica de manera cuidadosa y evitando obstruir el orificio con la jeringa. Esto se debe a que el aumento de presión intracraneal al introducir líquido puede ser considerable. Esto no ocurre al realizar dos burr-holes dado que el líquido posee una vía de salida (Figura 1).
Técnica de 2 orificios de trépano: se realizan 2 incisiones, generalmente mediales a la línea temporal superior y separadas por al menos 6 cm. La confección del bolsillo subperiostal debe ser circunferencial, uniendo ambas incisiones. Por lo general, se abre primero la cápsula parietal del orificio anterior y luego la del posterior. El lavado debe efectuarse a través de ambos orificios, favoreciendo un lavado de anterior a posterior. Finalmente, se coloca un drenaje en el bolsillo subperiostal, uniendo ambas incisiones y situándolo sobre los burr-holes (ver Figura 1).
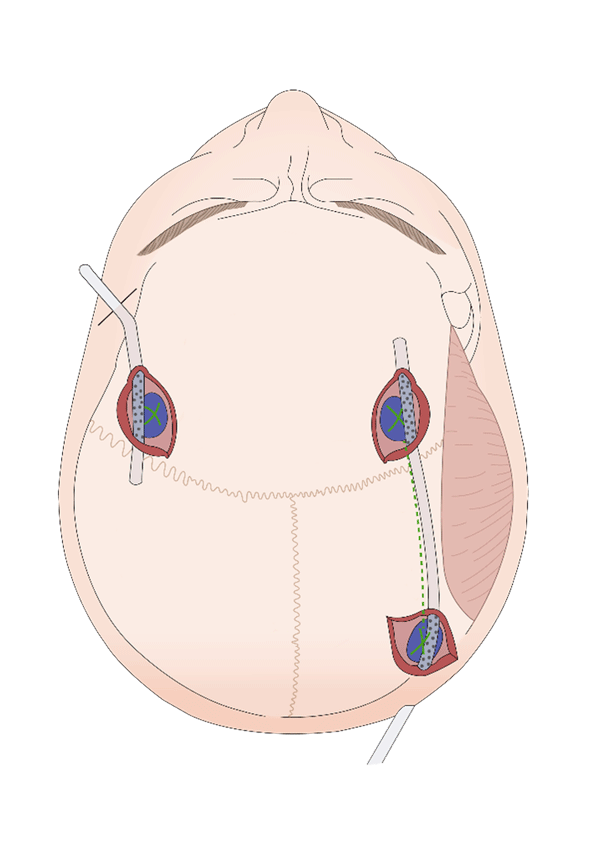
Figura 1. Representación de la ubicación de los orificios de trépano y su relación con respecto al drenaje en posición subperiostal. A la izquierda la técnica para 1 orificio y a la derecha la técnica para 2 orificios, donde se utiliza un solo drenaje que pasa a través de un bolsillo subperiostal que conecta ambas incisiones.
Postoperatorio
Después de la cirugía, el paciente es llevado a la unidad de recuperación anestésica para vigilancia. Luego, es trasladado a la sala de cuidados postquirúrgicos para continuar con su vigilancia, cuidados de la herida operatoria y un examen neurológico diario. Cuidados postoperatorios:
● El drenaje se mantiene semiaspirativo, con medición del débito cada 24 horas.
● El drenaje se retira a las 24 horas postquirúrgicas si el débito del drenaje es menor a 100 ml/24 h, o a las 48 horas según la condición del paciente.
● Se realiza una tomografía de encéfalo de control postoperatorio después del retiro del drenaje, o antes, si el paciente presenta deterioro neurológico o se sospecha de alguna complicación postquirúrgica.
Alta y seguimiento
Si la tomografía postoperatoria muestra una evacuación satisfactoria, el paciente es dado de alta el mismo día del retiro del drenaje. Se programa un control postoperatorio a las dos semanas posteriores al alta, con una tomografía de encéfalo de control. En ese momento, se evalúa el estado clínico del paciente y de la herida, además de posibles recidivas en las imágenes. Si no presenta complicaciones, es dado de alta de la especialidad, de lo contrario, seguirá en controles.
RESULTADOS
Entre marzo del 2020 y diciembre del 2024, un total de 281 pacientes fueron operados por hematoma subdural crónico. De estos, 7 eran menores de 18 años al momento del diagnóstico y 61 fueron operados mediante craneotomía, razón por la cual se excluyeron del análisis. En consecuencia, el análisis incluyó a 213 pacientes (Tabla 1). La edad promedio de la cohorte fue de 69.6 años, con una clara predominancia masculina (67.60%) sobre la femenina (32.40%). En cuanto a las comorbilidades, se observó una alta prevalencia de hipertensión arterial (59.62%), seguida de diabetes mellitus tipo 2 (27.23%). Un 38.96% de los pacientes presentaba alguna alteración de la coagulación, con un 16.90% bajo tratamiento antiagregante antiplaquetario y un 14.08% con anticoagulantes.
TABLA 1. CARACTERÍSTICAS CLÍNICAS Y DEMOGRÁFICAS DE LOS PACIENTES AL INGRESO
| Características | Resultados |
|---|---|
| Edad - años (DE) | 69.6 (± 14.98) |
| Sexo masculino – N.º (%) | 144 (67.40) |
| Comorbilidades | |
| HTA - N.º (%) | 127 (59.62) |
| DM2 - N.º (%) | 58 (27.23) |
| Trastornos de la coagulación - N.º (%) | 83 (38.96) |
| Antiagregación plaquetaria - N.º (%) | 36 (16.90) |
| Anticoagulantes - N.º (%) | 30 (14.08) |
| OH crónico - N.º (%) | 10 (4.69) |
| Escala de coma de Glasgow | |
| 13 a 15 - N.º (%) | 196 (92.01) |
| 9 a 12 - N.º (%) | 13 (6.11) |
| 3 a 8 - N.º (%) | 4 (1.88) |
| Síntomas de ingreso | |
| Compromiso de conciencia - N.º (%) | 112 (52.58) |
| Focalidad motora - N.º (%) | 157 (73.71) |
| Cefalea - N.º (%) | 110 (51.64) |
| Crisis epiléptica - N.º (%) | 16 (7.51) |
| Lateralidad | |
| Izquierdo - N.º (%) | 91 (42.72) |
| Derecho - N.º (%) | 77 (36.15) |
| Bilateral - N.º (%) | 45 (21.13) |
Al momento del ingreso, un 50.70% de los pacientes obtuvo un puntaje de GCS de 15, un 31.45% de 14, y un 12.21% entre 13 y 12 puntos. Solo un 5.64% presentó un GCS ≤11.
Los síntomas más frecuentes fueron focalidad motora (73.71%), compromiso de conciencia (52.58%) y cefalea (51.64%). Solo un 7.51% de los pacientes presentó crisis epiléptica como síntoma. La lateralidad del hematoma fue predominantemente izquierda (42.72%), seguida por derecha (36.15%). Un 21.13% de los casos fueron bilaterales.
La técnica quirúrgica predominante fue la evacuación mediante 1 único orificio de trépano (81.22%), con un tiempo quirúrgico promedio de 56.63 minutos, siendo ligeramente más prolongado en los casos de doble orificio de trépano (69.1 minutos vs. 53.72 minutos para un orificio de trépano). El drenaje postoperatorio se retiró mayoritariamente a las 48 horas (89.11%) (Tabla 2). La estadía hospitalaria promedio fue de 4.65 días, con un lapso promedio entre la hospitalización y la cirugía de 1.05 días.
TABLA 2. TÉCNICA QUIRÚRGICA Y DRENAJE
| Número de burr-holes | |
|---|---|
| 1 burr-hole - N.º (%) | 173 (81.22) |
| 2 burr-holes - N.º (%) | 40 (18.78) |
| Tiempo quirúrgico - minutos (DE) | 56.63 (± 1.55) |
| 1 burr-hole - minutos (DE) | 53.72 (± 1.65) |
| 2 burr-holes - minutos (DE) | 69.1 (± 3.61) |
| Retiro de drenaje | |
| 24 horas - N.º (%) | 10 (4.95) |
| 48 horas - N.º (%) | 180 (89.11) |
| >48 horas - N.º (%) | 12 (5.94) |
Un 90.29% de los pacientes presentó una resolución sintomática al momento del alta por la especialidad, mientras que un 7.77% manifestó una resolución parcial y solo el 1.94% (4 pacientes) no mostró mejoría.
La tasa de recidiva que requirió recirugía fue baja: 3.37% (7 pacientes), sin diferencias significativas entre el uso de 1 o 2 orificios de trépano (3.57% para 1 orificio vs. 2.5% para 2 orificios; p >0.05). En cuanto a otras complicaciones, un 1.88% de los pacientes (4 casos) falleció, un 2.82% presentó crisis epilépticas, el 2.35% tuvo algún tipo de complicación hemorrágica y un 0.94% se infectó. Hubo 2 casos de herniaciones transcalvarias de parénquima por los orificios (Tabla 3).
TABLA 3. RESOLUCIÓN SINTOMÁTICA, RECIDIVAS Y COMPLICACIONES
| Resolución de síntomas | |
|---|---|
| Sí - N.º (%) | 186 (90.29) |
| Parcial - N.º (%) | 16 (7.77) |
| No - N.º (%) | 4 (1.94) |
| Recidiva | |
| Sí - N.º (%) | 7 (3.37) |
| No - N.º (%) | 201 (96.63) |
| Complicaciones | |
| Fallece - N.º (%) | 4 (1.88) |
| Crisis epiléptica - N.º (%) | 6 (2.82) |
| Hemorragia - N.º (%) | 5 (2.25) |
| Infección - N.º (%) | 2 (0.94) |
| Herniación transcalvaria - N.º (%) | 2 (0.94) |
DISCUSIÓN
El HSDc es una de las patologías neuroquirúrgicas más frecuentes, especialmente en pacientes adultos mayores, y su incidencia está en aumento debido al envejecimiento poblacional y al uso creciente de fármacos anticoagulantes y antiagregantes. En nuestra serie de 213 pacientes tratados quirúrgicamente con burr-hole y drenaje subperiostal, observamos una distribución por edad y sexo concordante con la literatura, con una edad media de 69.6 años y una predominancia masculina del 67.6% (3:1), lo que reafirma la tendencia epidemiológica previamente descripta.(3,6)
Fisiopatología del HSDc
La relación entre el trauma y el HSDc ha sido ampliamente debatida. Inicialmente, se propuso que el trauma y la rotura de venas puentes eran los causantes de su producción. Lo que inicialmente sería un hematoma subdural agudo, producto de la degradación de la sangre, pasaría a una fase subaguda y luego a una crónica, conformando el HSDc.(1)
Lo anterior ha sido debatido en los últimos años, principalmente por ser una teoría que presenta problemas:
1. La rotura de pequeñas venas puente, de 1-3 mm de diámetro, hacia un espacio de diámetro menor a 20 μm, como es la capa interna de la duramadre, parece poco probable como la causa. Además, la ubicación habitual del HSDc en la convexidad contradice un sangrado activo de venas puentes que, en su mayoría, drenan hacia senos venosos mediales.(20)
2. Un sangrado venoso, y por lo tanto, de bajo flujo, presentaría síntomas en horas o días, mientras que la mayoría de los pacientes con historia de trauma debutan con un HSDc sintomático en un período de 4 a 7 semanas.(1)
3. Habitualmente, los pacientes que desarrollan un HSDc posterior a un trauma craneal poseen una tomografía de cerebro inicial sin sangrado.(1) Además, aproximadamente un 20% de los pacientes con hemorragia subdural aguda de manejo conservador desarrollan un HSDc.(21) Esto indicaría que no basta con un sangrado subdural agudo para ocasionar un HSDc.
4. Autopsias han revelado la ausencia de lesiones en venas puente, y estudios biomecánicos indican que se requiere un trauma al menos moderado para su rotura, lo que hace improbable pequeños sangrados, no evidenciables en la tomografía inicial.(20)
5. Por último, en la tomografía de cerebro el HSDc se ve como una lesión que en su mayor parte es hipodensa, lo que sugiere un sangrado “crónico”. Sin embargo, estas lesiones crecen en el tiempo, lo que indica que debe haber otros factores no traumáticos contribuyendo a su progresión.
Esta evidencia ha llevado a formular una nueva teoría sobre la producción del HSDc, en la que la inflamación crónica sumada al microtrauma llevarían a su producción y progresión en el tiempo.(1,4)
La duramadre posee una capa interna especializada de células denominada “las células del borde dural”, las cuales poseen un rol fagocítico y formador y proliferativo de tejido conectivo fibrocelular. Es este último rol el que permitiría la formación de membranas que encapsulan al HSDc.(1,2,23)
La lesión y delaminación de las células del borde dural, producto de un trauma o de otra causa, lleva a la activación de una respuesta inflamatoria con el objetivo de repararlas. Por factores no conocidos, esta respuesta inflamatoria activa su función proliferativa, comenzando la producción de membranas.(1,2)
Las células inflamatorias poseen factores proangiogénicos que permiten la neovascularización en este nuevo espacio formado entre las células del borde dural. Dichos vasos son inmaduros y de alta permeabilidad, con ausencia de membrana basal, músculo liso y pericitos. Además, poseen una gran cantidad de GAP-juntions, lo que facilita la migración de glóbulos rojos, leucocitos y plasma.(23,24) Estos vasos inmaduros y de alta permeabilidad llevan a constantes microhemorragias, con la consiguiente cronificación del proceso inflamatorio.
La delaminación de las células del borde dural genera 2 capas o membranas, una externa adherida a la duramadre y otra interna adherida a la aracnoides. Su proliferación no es idéntica, dado que la más interna está conformada por colágeno y fibrina, mientras que la externa está constituida además por células inflamatorias proangiogénicas, y posee vasos sanguíneos inmaduros en su interior. La cápsula externa o parietal tiene un rol más activo en la progresión y cronificación del HSDc que la cápsula interna o visceral.(1,23)
El estudio del líquido contenido en el HSDc también ha ayudado a comprender mejor esta enfermedad. Altos niveles de productos de la degradación de la fibrina/fibrinógeno se han encontrado en este líquido, lo que habla de un proceso continuo de fibrinolisis. Algo que apoya esto es el hallazgo de glóbulos rojos frescos en él.(25) Junto con esto, se han encontrado altos niveles de factores proangiogénicos como angiopoyetina-2 y VEGF y altos niveles de factores proinflamatorios como son las IL-6 e IL-8.(26,27)
El manejo quirúrgico del HSDc, aunque estandarizado en gran parte del mundo, aún deja espacio para la optimización de técnicas que reduzcan la tasa de complicaciones, principalmente la recidiva. Uno de los aportes más relevantes de este estudio es la descripción de una técnica quirúrgica modificada que incorpora la confección de un bolsillo subperiostal amplio y el uso sistemático de drenajes a este nivel, estrategia que, según nuestro conocimiento, ha sido escasamente reportada en la literatura. Esta modificación se alinea con la comprensión actual de la fisiopatología del HSDc, que ha evolucionado desde una visión meramente traumática hacia un modelo inflamatorio crónico, con proliferación de membranas, angiogénesis patológica y microhemorragias recurrentes, lo que genera un contenido subdural de alta osmolaridad.(1,2,23)
Nuestra hipótesis es que el lavado de la cavidad subdural con suero fisiológico reduce la osmolaridad del contenido del hematoma y elimina factores inflamatorios, disminuyendo el riesgo de recurrencia. Tras la evacuación, el líquido residual continúa drenándose a través del orificio de trépano gracias a la reexpansión cerebral pulsátil y es absorbido por el periostio, incluso después del retiro del drenaje.
La elección del drenaje subperiostal en lugar de uno subdural responde a consideraciones tanto anatómicas como fisiopatológicas. Al colocarlo en este plano se evita la manipulación directa del espacio subdural, lo que podría reducir el riesgo de infección, hemorragia y daño cortical asociado. Además, permite mantener abierto el bolsillo subperiostal durante el período postoperatorio.
En nuestra cohorte, se observó una tasa de recidiva quirúrgica del HSDc del 3.37%, más baja que lo reportado en la literatura (10–20%), lo cual es alentador considerando que nuestra técnica quirúrgica modificada no fue universalmente adoptada desde el inicio del período de estudio. La resolución sintomática al alta en la gran mayoría de nuestros pacientes (90.29%) también apoya la efectividad de nuestra estrategia quirúrgica.(2,6,15)
En la mayoría de los pacientes que debieron ser reoperados por recidiva se describe en el intraoperatorio la presencia de una obstrucción del orificio de trépano. Esto refuerza nuestra hipótesis de que la evacuación y disminución de la osmolaridad del hematoma en el intraoperatorio es solo una parte del tratamiento de esta enfermedad, y que en los días posteriores a la cirugía el líquido de menor osmolaridad sigue siendo evacuado por los orificios y reabsorbido por el periostio.
Aunque no encontramos diferencias significativas en la tasa de recidiva entre la técnica de 1 o 2 burr-holes, la tendencia ligeramente menor en el grupo de 2 orificios podría sugerir un beneficio de esta técnica en casos específicos, aunque se requiere un análisis más profundo con una mayor muestra para confirmar esta observación. Sin embargo, siguiendo nuestra hipótesis, lo anterior cobra sentido: al confeccionar 2 orificios se dobla el área de evacuación y hace menos probable que ambos se obstruyan al mismo tiempo.
Dos casos en nuestra cohorte presentaron una herniación transcalvaria a través del orificio realizado. Estos casos llamaron la atención en nuestro equipo y tras un análisis se concluyó que en ambos casos, durante el cierre de la piel, el drenaje subperiostal fue conectado a la aspiración central del pabellón para disminuir el neumoencéfalo. Esa conducta fue abandonada para futuros pacientes.
Este estudio presenta limitaciones inherentes a su diseño retrospectivo. Sin embargo, la inclusión de una cohorte considerable y la descripción detallada de una técnica quirúrgica poco difundida otorgan valor a sus hallazgos. A futuro, estudios prospectivos que comparen directamente esta técnica con los abordajes tradicionales, incluyendo análisis multivariados de factores pronósticos, podrían esclarecer su verdadero impacto clínico.
CONCLUSIONES
Nuestra experiencia con la técnica de evacuación de HSDc vía orificio de trépano, combinada con la confección de un amplio bolsillo subperiostal y el uso de un drenaje subperiostal, ha demostrado ser segura y eficaz en términos de baja tasa de recidiva y alta resolución sintomática, con escasas complicaciones postoperatorias.
Estos hallazgos sugieren que esta técnica podría representar una mejora respecto a las estrategias quirúrgicas convencionales, especialmente en centros que buscan optimizar sus resultados clínicos sin incrementar la complejidad del procedimiento.
Contribuciones de autoría
Conceptualización, Análisis formal, Metodología y Administración del proyecto: Hugo Romero Vinet. Curación de datos, Investigación y Redacción - borrador original: Hugo Romero Vinet, Edoardo Horlacher. Supervisión, Validación y Redacción - revisión y edición: Carlos Bennett Colomer.
BIBLIOGRAFÍA
COMENTARIO
La literatura respalda de manera consistente que el uso de drenajes tras la evacuación del hematoma subdural crónico reduce la tasa de recurrencias. Una revisión sistemática y metaanálisis reciente que incluyó 1961 pacientes demostró que el drenaje es superior a no utilizarlo, con un claro impacto en la reducción de reintervenciones.(1) Sin embargo, la eficacia del drenaje no solo depende de su empleo, sino también de factores técnicos. El estudio de Sjåvik y col., de 1260 pacientes, mostró que el drenaje activo subgaleal tuvo una recurrencia significativamente menor al observado con el drenaje subdural pasivo, sugiriendo una posible superioridad de este método.(2) Más recientemente, un metaanálisis reforzó estos hallazgos, señalando que los drenajes subgaleales/subperiósticos pueden asociarse a una menor tasa de recurrencia respecto a los subdurales.(3)
En este contexto, la experiencia reportada en este artículo resulta especialmente relevante, pues aporta evidencia clínica de la efectividad del drenaje subperióstico con confección de un bolsillo subgaleal, técnica que alcanzó una baja tasa de recurrencias, inferior a la reportada en series clásicas con drenaje subdural. No obstante, además del tipo y localización del drenaje, existen otras variables técnicas y perioperatorias que podrían influir en los resultados, como el tipo de anestesia empleada, el número de días que se mantiene el drenaje o la cantidad de orificios realizados durante la cirugía. Estas condiciones podrían impactar tanto en la tasa de recurrencia como en la recuperación postoperatoria.
Una limitación relevante del estudio es su carácter retrospectivo, lo que restringe la capacidad de establecer conclusiones definitivas. En este sentido, un estudio prospectivo y comparativo, que homogeneice dichas variables y contraste de manera directa las distintas técnicas de drenaje, sería de gran utilidad para determinar con mayor precisión la efectividad del método descripto.
Por último, quisiera felicitar a los autores por compartir su experiencia. Esta contribuye de manera significativa al debate actual y al perfeccionamiento del manejo quirúrgico del hematoma subdural crónico.
Florencia Rodríguez Basili
División Neurocirugía, Hospital General de Agudos “J. M. Ramos Mejía”,
Ciudad de Buenos Aires, Argentina
BIBLOGRAFÍA