Siringomielia espinal primaria desencadenada por una fístula espinal espontánea de líquido cefalorraquídeo
Juan José María Mezzadri,1 Ricardo Cragnaz,2 Héctor Eduardo Lambre3
1. Programa de Chiari y Siringomielia, Departamento de Neurocirugía, Instituto de Neurociencias, Hospital Universitario Fundación Favaloro, Ciudad Autónoma de Buenos Aires, Argentina
2. Clínica “25 de Mayo”, Mar del Plata, Buenos Aires, Argentina
3. Departamento de Imágenes, Fundación para la Lucha contra las Enfermedades Neurológicas de la Infancia (FLENI), Ciudad Autónoma de Buenos Aires, Argentina
Recibido: 04/05/2024. Aceptado: 19/08/2024.
Juan José María Mezzadri
jjmezzadri@gmail.com
DOI: 10.59156/revista.v38i03.658
ORCID
Juan José María Mezzadri: 0000-0001-5075-5696
Ricardo Cragnaz: 0009-0001-1734-0170
Héctor Eduardo Lambre: 0000-0002-8718-3457
EMAILS
Ricardo Cragnaz: cragnaz@yahoo.com
Héctor Eduardo Lambre: hlambre@hotmail.com
Los autores no declaran conflicto de interés
Los autores no declaran financiamiento.
RESUMEN
Introducción: la obstrucción total o parcial de la circulación del líquido cefalorraquídeo (LCR) en el canal espinal puede producir siringomielia (SM). Una de sus causas son las fístulas espinales de LCR que al generar hipotensión intracraneana (HIC) por el drenaje excesivo de líquido producen un descenso amigdalino que obstruye la circulación del LCR.
Objetivos: describir y analizar un nuevo caso de SM causada por una fístula espinal de LCR entre los espacios subaracnoideo y extradural.
Descripción del caso: una mujer de 44 años consultó por cefaleas y paresia en ambas manos. Había sido intervenida en dos oportunidades con diagnóstico de Chiari I: descompresión cráneo espinal y duroplastia y luego su revisión. La resonancia mostró un descenso amigdalino con siringomielia y un refuerzo meníngeo difuso postcontraste. Se hizo el diagnóstico de HIC. La mielotomografía mostró un quiste radicular derecho en T11-T12 con salida de LCR al espacio extradural.
Intervención: luego de analizar las imágenes se decidió abordar el quiste radicular inyectando 10 cm3 de sangre autóloga bajo control tomográfico. La resonancia de control mostró un ascenso de las amígdalas cerebelosas y una resolución completa de la siringomielia, cambios que se mantuvieron en controles posteriores.
Conclusión: la HIC debe ser considerada como una causa potencial de siringomielia asociada al descenso amigdalino. En este caso, el tratamiento de su causa, una fístula espontánea de LCR tipo 2a mediante un parche sanguíneo dirigido, produjo la reversión del descenso amigdalino con resolución de la siringomielia.
Palabras clave: Fístula de LCR. Hipotensión intracraneana. Parche epidural sanguíneo. Siringomielia.
Primary spinal syringomyelia triggered by a spontaneous spinal cerebrospinal fluid fistula
ABSTRACT
Background: total or partial obstruction to the circulation of cerebrospinal fluid (CSF) in the spinal canal can cause syringomyelia (SM). One of its causes is spinal CSF fistulas that, by generating intracranial hypotension (ICH) due to excessive fluid drainage, produce tonsillar descent that obstructs CSF circulation.
Objectives: to describe and analyze a new case of SM caused by a spinal CSF fistula between the subarachnoid and extradural spaces.
Case description: a 44-year-old woman presented with headaches and paresis in both hands. She had undergone surgery twice with a diagnosis of Chiari I: cranio-spinal decompression and duraplasty and then revision of the duraplasty. MRI showed tonsillar descent with syringomyelia and diffuse post-contrast meningeal enhancement. The diagnosis of ICH was made. Myelotomography showed a right radicular cyst at T11-T12 with CSF leakage into the extradural space.
Intervention: after analyzing the images, it was decided to address the radicular cyst by injecting 10 cm3 of autologous blood under tomographic control. The control MRI showed an elevation of the cerebellar tonsils and a complete resolution of the syringomyelia, changes that were maintained in subsequent controls.
Conclusion: ICH should be considered as a potential cause of syringomyelia associated with tonsillar descent. In this case, treatment of its cause, a type 2a spontaneous CSF fistula, using a targeted blood patch produced reversal of tonsillar descent with resolution of the syringomyelia.
Keywords: Blood epidural patch. CSF fistula. Intracranial hypotension. Syringomyelia.
INTRODUCCIÓN
La siringomielia (SM) es una dilatación quística de la médula espinal secundaria a una obstrucción total o parcial a la circulación del líquido cefalorraquídeo (LCR). Dicha obstrucción puede estar localizada en la fosa posterior (Chiari, quistes aracnoideos, etc.), o en el canal espinal (aracnoiditis, espondilosis, etc.).
Cuando el “evento primario” que desencadena el desarrollo de una SM se encuentra en el canal espinal hablamos de siringomielia espinal primaria (SEP).1 Una de sus causas son las fístulas espontáneas (FE) o postraumáticas de LCR ocurridas entre los espacios subaracnoideo y extradural, o entre el espacio subaracnoideo y las venas epidurales.2,3 Inicialmente aparecen síntomas de hipotensión intracraneana (HIC) debido al drenaje excesivo de LCR que se produce a través de la fístula; el síntoma más característico, entre muchos otros, es la cefalea ortostática. Hay muy pocos casos descriptos de FE de LCR que hayan desarrollado una SEP (Tabla 1).2,4-13
TABLA 1. CASOS PUBLICADOS DE SIRINGOMIELIA SECUNDARIA A UNA FÍSTULA ESPINAL ESPONTÁNEA DE LCR
Publicación |
Sexo - Edad |
Sitio |
Tipo de fístula |
Patología asociada |
Tratamiento inicial |
Tratamiento posterior |
Evolución |
Sharma y cols. (2001) |
Mujer - 32 años |
Colección extradural entre foramen magno y C2 con extensión por la raíz C2 derecha a la región paraespinal |
Tipo 1a |
No |
Reposo, sin éxito |
DCE + taponamiento con esponja de gelatina sobre la duramadre |
A los 3 meses asintomática con ascenso amigdalino y resolución de la SM |
Owler y cols. (2004) |
Mujer - 27 años |
No determinado, con ectasia dural lumbar |
Tipo 2b |
Enfermedad de Marfan |
Reposo, con resultado efectivo |
Ninguno |
A los 4 meses asintomática solo resolvió la SM |
Scholsem y cols. (2008) |
Hombre - 17 años |
Avulsión de la raíz C8 con efusión pleural derecha |
Tipo 1a |
Avulsión del plexo braquial |
Ninguno |
Cierre del desgarro dural en raíz C8 |
A los 4 meses asintomático con ascenso amigdalino y resolución de la SM |
Kranz y cols. (2011) |
Mujer - 53 años |
Divertículos torácicos múltiples sin determinación del sitio fistuloso |
Tipo 2a |
No |
Shunt S-S sin resultados |
PES en todos los quistes |
A los 9 meses asintomática con ascenso amigdalino y resolución de la SM (*) |
Smith y cols. (2015) |
Mujer - 45 años |
Fístula T5-T7 |
Tipo 1a |
No |
PES con alivio transitorio |
PES + cola de fibrina 5 años después |
Asintomática sin referencias al descenso amigdalino o a la resolución de la SM |
Yoshimoto y cols. (2018) |
Mujer - 19 años |
Fístula lumbar |
Tipo 2b |
Enfermedad de Gorham-Stout |
PES con alivio transitorio |
Repetición del PES por recidiva al año |
Al año mejoría sintomática con ascenso amigdalino y resolución de la SM |
Middelbrooks y cols. (2020) |
3 varones y 3 mujeres - edad media 52.5 años |
1 caso fístula LCR-venosa, 1 caso fístula torácica, en el resto no hay datos |
1 tipo 1a, 1 tipo 3, en el resto no hay datos |
No |
1 caso con DCE sin éxito |
PES o sellador dural en todos, 1 caso cierre del desgarro dural, 1 caso cierre fístula LCR-venosa |
En 4 mejoría o resolución de la cefalea, en 3 resolución de la SM con ascenso amigdalino en 1 |
Hsieh y cols. (2022) |
Mujer - 30 años |
Fístula LCR-venosa en raíz C7 derecha |
Tipo 3 |
Síndrome de Evans |
PES + sellador dural en 2 oportunidades sin éxito |
DCE + duraplastia |
A los 8 meses asintomática y resolución de la SM |
Krivoshapkin y cols. (2022) |
Mujer - 47 años |
Fístula T9-T10 |
Tipo 1a |
Artrosis |
Ninguno |
Taponaje con sellador dural y esponja de fibrina |
A los 9 meses asintomática con ascenso amigdalino y resolución de la SM |
Oh y cols. (2023) |
Mujer - 32 años |
Fístula C1-C2 y lumbar múltiple |
Tipo 1a |
No |
Reposo |
Ninguno |
A los 4 meses asintomática con ascenso amigdalino y resolución de la SM |
Park y cols. (2023) |
Mujer – 51 años |
Fístula T8 |
Tipo 1a |
Hernia discal t8 |
DCE + shunt S-S con peoría |
Taponaje con sellador dural |
Mejoría sintomática y de la SM sin referencias al descenso amigdalino |
Park y cols. (2023) |
Mujer – 68 años |
No hay datos |
No hay datos |
No hay datos |
PES |
Ninguno |
Mejoría sintomática y de la SM sin referencias al descenso amigdalino |
(*) Parecido a nuestro caso. DCE: descompresión cráneo espinal. LCR: líquido cefalorraquídeo. PES: parche epidural sanguíneo. SM: siringomielia.
OBJETIVOS
Describir y analizar el diagnóstico y tratamiento de un nuevo caso de SEP desencadenado por una FE de LCR entre los espacios subaracnoideo y extradural espinales.
DESCRIPCIÓN DEL CASO
Una mujer de 44 años concurrió a consulta en marzo del 2023 por sufrir cefaleas suboccipitales y disminución de la fuerza en ambas manos. Como antecedentes refirió que, con el diagnóstico de malformación de Chiari I y siringomielia, había sido operada en dos oportunidades: en la primera (abril 2020) se le realizó una descompresión cráneo espinal (DCE) con duroplastia con mejoría clínica y de las imágenes, y en la segunda (mayo 2022), por empeoramiento clínico y de las imágenes, se efectuó una revisión de la duroplastia.
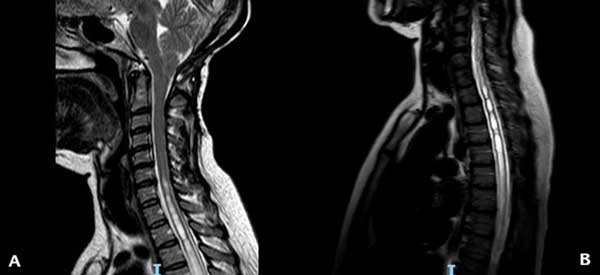
En el momento de la consulta, el examen físico presentó una leve paresia distal en ambos miembros superiores, hipoestesia termoalgésica en la mano y región subescapular izquierdas e hiperreflexia en ambos miembros inferiores. La resonancia magnética (RM) de encéfalo y columna cervical mostró un descenso marcado de las amígdalas cerebelosas con siringomielia cervicodorsal (Figura 1). Luego de la administración de contraste, se observó un refuerzo difuso de las meninges y senos venosos compatibles con hipotensión intracraneana (Figura 2). Ante la sospecha de una fístula espinal espontánea de LCR, se decidió realizar un estudio contrastado intratecal para determinar el sitio de la pérdida.

Figura 1. RM ponderada en T2 que muestra en (A) el descenso amigdalino y la siringomielia cervical y en (B) la extensión de la siringomielia a nivel torácico.

Figura 2. RM ponderada en T1 luego de la administración de contraste que muestra el refuerzo meníngeo.
En julio del 2023 se efectuó una inyección de contraste yodado (iopamidol 370) por vía intratecal lumbar a razón de 1 cm3/segundo en la camilla del tomógrafo (GE light speed de 16 hileras) en decúbito ventral. Esto ocasionó una importante cefalea que fue cediendo en los minutos siguientes. Inmediatamente concluida la inyección, se realizó la adquisición en modo helicoidal de la columna lumbar y posteriormente se fueron obteniendo secuencias de la columna dorsal siguiendo el ascenso del contraste. A nivel T11/12 se identificó un quiste de la vaina radicular derecha que mostraba extravasación del medio de contraste al espacio extradural en dirección cefálica hasta aproximadamente T7 (Figura 3).
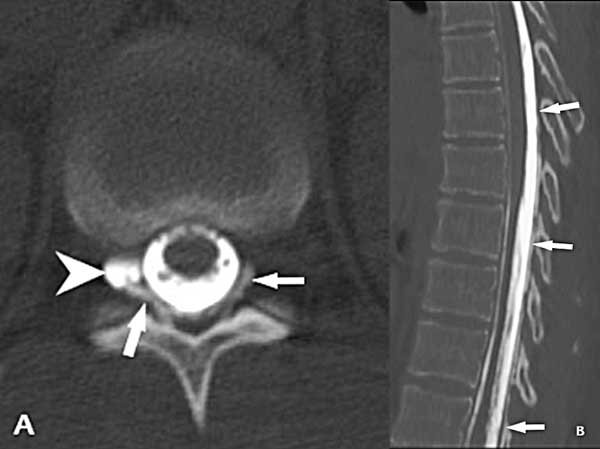
Figura 3. Mielo-TC. A) Corte axial a nivel T12/L1 que muestra el llenado del quiste radicular derecho (punta de flecha) y la salida del medio de contraste al espacio extradural (flechas). B) Reconstrucción sagital de la columna dorsal que muestra el ascenso del medio de contraste por fuera de la duramadre dorsal hasta el nivel T7 (flechas).
Luego de analizar las imágenes se decidió abordar el quiste radicular. En decúbito ventral se dirigió una aguja espinal 21G hasta el neuroforamen, inyectando 2 cm3 de lidocaína al 1% marcada con contraste yodado, se identificó, así, el llenado del componente extradural del quiste sin pasaje al saco tecal (Figura 4); comprobado esto, se inyectaron seguidamente 10 cm3 de sangre autóloga recientemente extraída a la paciente.
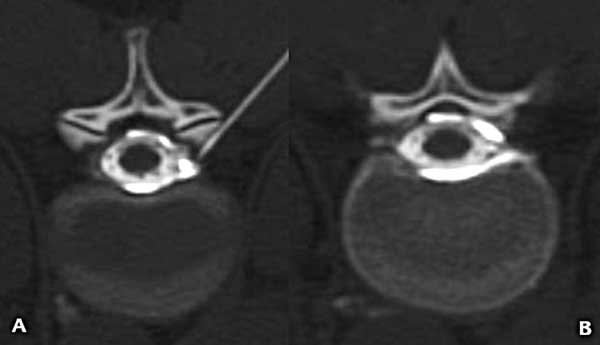
Figura 4. Mielo-TC. A) Corte axial donde se puede ver el extremo de la aguja en el neuroforamen y el medio de contraste que rellena el espacio peridural. B) Corte axial inmediatamente por encima de la figura 3 en el que se observa el medio de contraste concentrado en el espacio peridural sin pasaje al interior del saco tecal.
Concluido el procedimiento, la paciente fue internada para permanecer en decúbito por 3 días. Posteriormente presentó un intenso dolor lumbar resistente al tramadol, náuseas y vómitos. Al día siguiente, por dificultad para orinar y por la presencia de un globo vesical, fue sondada. Al tercer día se encontró una Escherichia Colli en el urocultivo por lo que fue tratada con antibióticos, con buenos resultados. Luego de comprobar que la bipedestación durante 30 minutos no despertaba cefaleas, se dio de alta. Se recomendaron 7 días de reposo en cama con permiso para levantarse durante 30 minutos para higiene y alimentación el primer día, 1 hora al día siguiente y sumando 1 hora por día hasta el día séptimo.
La RM de control realizada en octubre 2023 mostró un ascenso de las amígdalas cerebelosas y una resolución completa de la siringomielia (Figura 5). Actualmente sigue bajo control y solo persisten una leve hipoestesia en la mano izquierda y parestesias en la región subescapular izquierda.
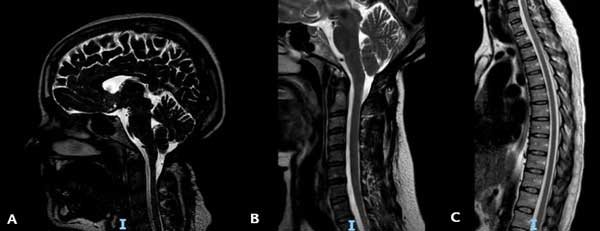
Figura 5. RM ponderada en T2 en la que se observa: A) El ascenso amigdalino. B) La resolución de la siringomielia cervical. C) La resolución de la siringomielia torácica.
DISCUSIÓN
La SM nunca es un evento primario. Generalmente es secundaria a patología ubicada en la fosa posterior o dentro del canal vertebral. El caso aquí descripto indica que la SM fue un “evento terciario” y que la obstrucción a la circulación del LCR fue producida por el descenso amigdalino, al que consideramos como un “evento secundario” ocasionado por la hipotensión intracraneana (HIC), debido al drenaje excesivo de LCR a través de la fístula espinal (Diagrama 1).
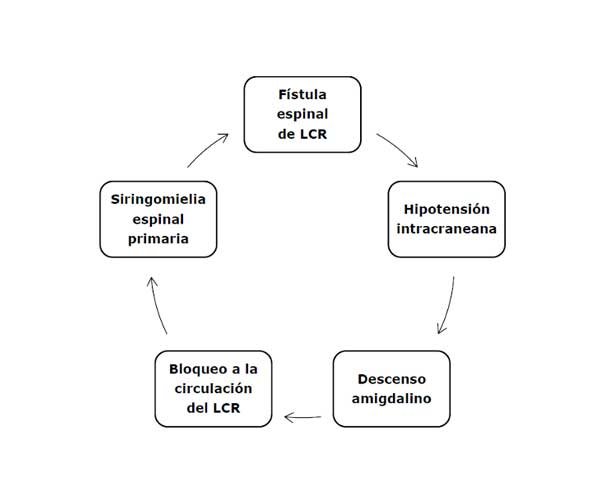
Diagrama 1. Cadena de eventos que conducen al desarrollo de la siringomielia.
En revisiones recientes se han descripto las características del síndrome de HIC.14-16 Tiene una incidencia anual estimada de 5/100000, afecta más a las mujeres que a los varones (2:1) alrededor de los 40 años. El síntoma característico de la HIC es la cefalea ortostática que aparece a los 15 minutos de pasar del decúbito a la estancia de pie, empeorando a lo largo del día. Sin embargo, no siempre es así: en ocasiones puede faltar, y en pacientes que han sufrido cefaleas por varios meses, esta puede perder su dependencia al cambio de posición e incluso puede aparecer al reclinarse. El 50% de los pacientes se quejan de síntomas auditivos como tinnitus, sensación de presión en los oídos o pérdida brusca de la audición. Otros síntomas comunes son: cervicalgia, náuseas, vómitos, desequilibrios, visión borrosa, defectos campimétricos, fotofobia, adormecimiento facial y fatiga. Menos frecuentemente, algunos pueden desarrollar coma o una demencia frontotemporal. Todos los síntomas son consecuencia del desplazamiento caudal (“sagging”) del encéfalo que pone en tensión los tejidos del cerebro, pares craneanos, vasos y meninges. Cuando aparece una SM se suman los síntomas de compresión medular y/o radicular.17
Para el diagnóstico de HIC no solo hay que basarse en la clínica, sino también en la resonancia magnética (RM) donde sus hallazgos principales son: colecciones subdurales, refuerzo meníngeo, ingurgitación venosa, ingurgitación de la hipófisis y desplazamiento caudal del cerebro. Según Middlebrooks y cols.,9 en los casos de FE con SM, el óbex está por debajo del foramen magno (promedio 3.7 ± 2.2 mm) y las amígdalas cerebelosas descienden en promedio 12.7 ± 4.7 mm, mientras que, en los casos sin SM, el óbex está por encima del foramen magno (promedio 1.9 ± 3.1 mm) y las amígdalas cerebelosas descienden en promedio 5.9 ± 2.5 mm.
Las fístulas espinales de LCR pueden ser espontáneas, postraumáticas o iatrogénicas.18 Dentro de las FE existen 4 tipos:
El caso presentado sería un tipo 2a. Los casos de FE asociadas a SM descriptos previamente serían: 7 tipo 1a, 1 tipo 2a, 2 tipo 2b, 2 tipo 3 y 5 sin determinar. Todos presentaron descenso de las amígdalas (ver Tabla 1).
El diagnóstico de las FE espinales se realiza con neuroimágenes. La RM con gadolinio intravenoso es el primer estudio a solicitar, nos muestra evidencias de HIC, colecciones extradurales de LCR, quistes y divertículos meníngeos. Luego, son necesarios los estudios con la administración de contraste intratecal: RM y mielotomografía; estos estudios son capaces de exponer la salida de LCR detectando el sitio de la pérdida, sobre todo en las fístulas tipo 1 y 2.15 En las fístulas tipo 3, el sitio de la pérdida suele no aparecer. En esos casos es necesaria la mielografía con sustracción digital, o simplemente una mielotomografía que muestre el signo de la “vena paraespinal hiperdensa”, representando el pasaje de LCR hacia el sistema venoso por el trayecto fistuloso.19,20
En el caso descripto los síntomas de presentación coincidían más con los de una malformación de Chiari tipo I congénita asociada a una SM que con los de una HIC. Probablemente, es por esto que la paciente fue intervenida en dos oportunidades con diagnóstico de Chiari tipo I. Ante la falta de los resultados esperados y la presencia de refuerzo meníngeo en la RM se cambió la orientación diagnóstica presumiéndose una HIC, cuya causa hubo que determinar.
En la mayoría de los casos publicados hasta la fecha el tratamiento de la FE produjo un ascenso de las amígdalas y la resolución de la SM (ver Tabla 1). Sin embargo, en ocasiones hay que hacer el diagnóstico diferencial con la malformación de Chiari I congénita; las patologías pueden combinarse. En el caso descripto por Hatae y cols. se planteó esta disyuntiva: luego de tratar una fístula espinal postraumática tipo 1a, después de 2 años de evolución y a pesar de estar asintomático, no se produjo el ascenso esperado de las amígdalas ni la resolución de la SM por corrección de la presión intracraneana como ocurrió en los casos publicados de FE (ver Tabla 1). Por lo tanto, y ante esa situación, los autores plantearon el doble diagnóstico: fístula espinal postraumática coincidente con una malformación de Chiari I congénita.21
La SM, al ser un evento, a veces, secundario, o como en este caso terciario, nos obliga a tratar siempre su causa para obtener buenos resultados. Por eso, en el estudio de Kranz y cols., fracasó la colocación de un shunt como tratamiento inicial.6 En algunas de las FE con SM descriptas se realizó una DCE.2,10 Sharma y cols. no dieron explicaciones sobre la razón por la cual efectuaron dicha descompresión; creemos que la mejoría se debió al taponamiento dural y no a la DCE. En cambio, Hsieh y cols., en contra de lo esperado, a los 8 meses luego de la DCE, lograron controlar la SM; es probable que la hipotensión intracraneal espontánea secundaria a la fístula haya mejorado naturalmente como ocurre en tantos casos, y no por la DCE.
Para el tratamiento de la HIC por FE de LCR espinales en primer lugar se opta por el reposo y la medicación sintomática como la cafeína. Si no hay respuesta, la segunda línea de tratamiento consiste en la aplicación de un parche epidural de sangre, dirigido o difuso. En caso de fracaso queda la alternativa quirúrgica, cuyas opciones dependerán del tipo de FE (Tabla 2).
TABLA 2. TIPO DE TÉCNICA QUIRÚRGICA DE ACUERDO CON EL TIPO DE FÍSTULA
Tipo 1a |
Identificación de la brecha dural bajo microscopio y reparación mediante sutura o taponamiento con músculo y sellador dural |
Tipo 1b |
Identificación de la brecha dural bajo microscopio y reparación mediante sutura o taponamiento con músculo y sellador dural |
Tipo 2a |
Cierre del divertículo o quiste aracnoideo |
Tipo 2b |
En caso de ectasia dural recubrimiento dural con un injerto |
Tipo 3 |
Clipado si es una vena única o coagulación si es un plexo venoso |
Tipo 4 |
Reducción dural |
En el caso presentado no optamos por el reposo. Creímos que no se habrían obtenido buenos resultados ya que, por la HIC, al tener una DCE, se seguiría favoreciendo el descenso amigdalino y por ende el desarrollo de la SM. Al igual que en el caso de Kranz y cols., se efectuó un parche epidural de sangre dirigido directamente al quiste de la vaina radicular con excelentes resultados.6
Uno de los problemas del síndrome de HIC es el retraso en su diagnóstico. Esto obedece a su escasa prevalencia y al poco conocimiento que de esta entidad poseen los especialistas. También las presentaciones clínicamente atípicas hacen que el retraso sea aún mayor. En el caso descripto el diagnóstico se concretó 3 años después del comienzo de los síntomas. En otros, el retraso llegó a ser de 2,13 4,2 5,7 y 8 años,13 incluso, la falta de diagnóstico en el síndrome HIC puede tardar hasta 13 años.22 Esto no solo lleva a un retardo en instalar un tratamiento adecuado, sino que también da lugar a la realización de tratamientos inapropiados que pueden complicarse hasta ocasionar la muerte por un infarto cerebral.23
CONCLUSIÓN
La HIC debe ser considerada como una causa potencial de siringomielia asociada al descenso amigdalino. En este caso, el tratamiento de su causa, una fístula espontánea de LCR tipo 2a, mediante un parche sanguíneo dirigido produjo la reversión del descenso amigdalino con resolución de la siringomielia.
Este es un artículo de acceso abierto bajo la licencia CC BY-NC https://creativecommons.org/licenses/by-nc/4.0/
BIBLIOGRAFÍA