¿Se puede predecir el grado histopatológico de un meningioma?
AugustoVilariño1, Emmanuel Alejandro Vázquez2, Carina Balasini3, Ricardo Horacio Menendez1
1.Servicio de Neurocirugía, Hospital Alemán de Buenos Aires, Argentina
2.Servicio de Neurocirugía, Hospital Santa Isabel de Hungría de Mendoza, Argentina
3.Unidad de Oncología, Hospital Ignacio Pirovano, Buenos Aires, Argentina
RESUMEN
Introducción: Los meningiomas son tumores intracraneales comunes de comportamiento generalmente benigno y crecimiento lento. La resección quirúrgica es el tratamiento curativo de elección. Sin embargo, ciertos meningiomas pueden presentar un patrón de crecimiento agresivo con tendencia a la recurrencia, y en raros casos metástasis a distancia. Las imágenes de Resonancia Magnética (RM) y Tomografía Computada (TC) han sido estudiadas para intentar identificar signos y características que se relacionan con mayor agresividad.
Objetivo: Evaluar e identificar características de las imágenes prequirúrgicas en conjunto con otras variables que permitan predecir un comportamiento tumoral agresivo.
Material y métodos: Se realizó un estudio retrospectivo observacional evaluando a todos los pacientes mayores de 18 años que requirieron intervención quirúrgica con diagnóstico de meningioma durante el periodo de enero 2015 a diciembre de 2019. Los 3 grados histológicos (OMS) se categorizaron en 2 grupos: bajo grado (Grado I) y alto grado (Grados II y III). Fueron analizadas y correlacionadas variables epidemiológicas, de anatomía patológica y estudios de imágenes.
Resultados: Durante el período estudiado fueron intervenidos quirúrgicamente 56 pacientes con diagnóstico de meningioma de los cuales 39 (70%) se consideraron de bajo grado y 17 (30%) de alto grado. En este último grupo, 9 (16%) fueron grado II y 8 (14%) grado III. Variables como el sexo masculino (p = 0.01), el realce heterogéneo y el valor bajo de coeficiente de difusión aparente (ADC) fueron estadísticamente significativas para predecir la malignidad de la lesión.
Conclusión: En nuestro estudio se observó una correlación positiva entre sexo masculino, realce heterogéneo y valor bajo de ADC con meningiomas agresivos.
Palabras clave: Coeficiente de difusión aparente; Gamma Knife; Grado tumoral; Meningioma
ABSTRACT
Background: Meningiomas are common intracranial tumors. They are generally characterized as benign slow-growing lesions. Surgical resection is the treatment of choice. However, certain meningiomas can present an aggressive growth pattern with a tendency to recurrence and, in rare cases, distant metastases.
Magnetic Resonance Imaging (MR) and Computed Tomography (CT) images have been studied in order to identify signs and characteristics which could be related to higher-grade meningiomas.
Objective: The objective of this manuscript was to identify features in preoperative images in conjunction with other variables to predict an aggressive biological behavior in meningiomas.
Material and methods: An observational retrospective study was conducted evaluating all patients over 18 years of age who underwent surgical resection with a diagnosis of meningioma during the period from January 2015 to December 2019. Epidemiological variables, pathological anatomy and imaging studies were analyzed.
Results: During the period studied, 56 patients were diagnosed with meningioma, in which study 39 (70%) were considered low grade and 17 (30%) high grade in the latter group 9 (16%) were grade II and 8 (14%) grade III. Variables such as male sex (p = 0.01), heterogeneous enhancement and low apparent diffusion coefficient (ADC) were statistically significant to predict the malignancy of the lesion.
Conclusion: In our study, a positive correlation was observed between male sex, heterogeneous enhancement and low ADC value with aggressive meningiomas.
Key words: apparent diffusion coefficient; Gamma Knife; Meningioma; tumor grade
MATERIAL Y MÉTODOS
Se realizó un estudio retrospectivo observacional.
Fueron incluidos todos los pacientes mayores de 18 años, ingresados al Servicio de Neurocirugía en forma consecutiva desde el 1 de enero de 2015 al 31 de diciembre de 2019, que requirieron intervención quirúrgica con diagnóstico de meningioma.
Las imágenes fueron analizadas por un médico radiólogo especializado en SNC sin conocimiento del diagnóstico histopatológico previo.
Se excluyeron de este análisis los pacientes con recidiva tumoral.
Los 3 grados histológicos (OMS) se categorizaron en 2 grupos: bajo grado (Grado I) y alto grado (Grados II y III) (Figuras 1, 2 y 3).

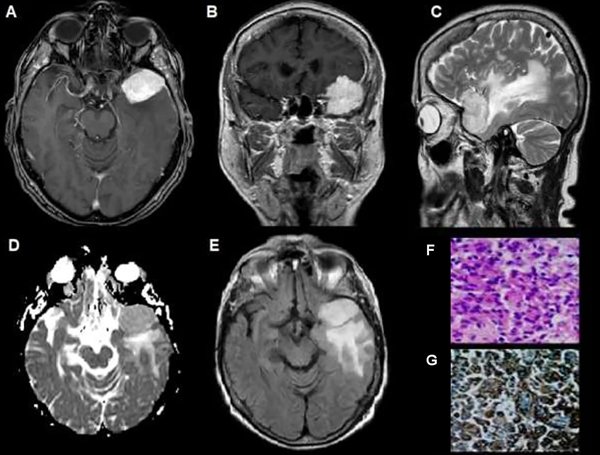
Figura 1. Meningioma del ala del esfenoides, grado I OMS. (A) RM axial T1 con Gd: lesión con captación hiperintensa y homogénea (flecha). (B) RM axial T1. (C) RM sagital T2: edema perilesional de aspecto hiperintenso (flecha). (D) Mapa de ADC: Comportamiento hiperintenso con aumento de intensidad (flecha). (E) RM FLAIR axial con captación hiperintensa de edema perilesional. (F y G) Microscopía: Proliferación compuesta por células de citoplasma amplio y núcleo redondeado u oval con pseudoinclusiones. Se observa abundante cantidad de vasos dilatados regulares.
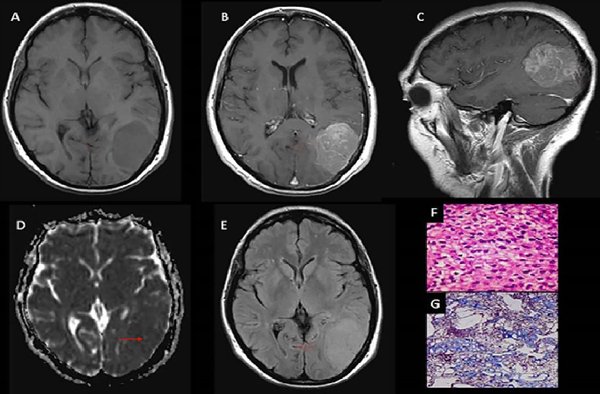
Figura 2. Meningioma de células claras, grado II OMS. (A) RM T1 axial: Meningioma parietooccipital izquierdo que produce efecto de masa (flecha). (B y C) T1 axial y sagital con Gd: Realce tenue heterogéneo (flechas). (D) Mapa de ADC: Comportamiento isointenso con aislados sectores de aumento de intensidad (flecha). (E) RM Flair axial: Efecto de masa, sin edema vasogénico (flecha). (F y G) Microscopía: Proliferación meningocelular con sectores de hipercelularidad y aumento de la tasa núcleo-citoplasma, con presencia de necrosis tumoral multifocal y sectores de atipia nuclear con nucléolos y 5 mitosis por 10 campos de aumento.
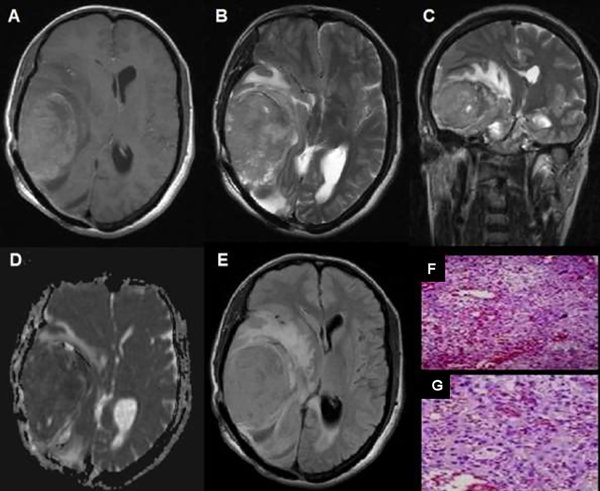
Figura 3. Meningioma rabdoide, grado III OMS. (A) RM axial T1: Meningioma temporoocipital derecho con edema perilesional significativo (flecha). (B) RM axial T2: Comportamiento heterogéneo con edema perilesional (flecha).(C) RM coronal T2: comportamiento hiperintenso con abundante edema perilesional. (D) Mapa de ADC:Comportamiento hiperintenso con disminución de intensidad (flecha). (E) RM FLAIR axial: Lesión extensa con abundante edema perilesional, (F y G) Microscopía: Meningioma con amplios sectores de diferenciación rabdoide, presencia de pleomorfismo y atipia nuclear, que alterna con sectores fusocelulares, necrosis y más de 20 mitosis por 10 campos de aumento.
Fueron analizadas variables epidemiológicas, anatomía patológica y estudios de imágenes de cada paciente. Todos los pacientes fueron estudiados con Tomografía Computada (TC) Multislice con contraste, (SOMATOM Sensation 16, Siemens, Alemania) y Resonancia Magnética (RM), con un scanner de 1.5T (Magnetom Symphony, Siemens, Alemania) incluyendo secuencias convencionales, eco de gradiente, DWI (técnica de difusión), ADC y gadolinio.
Fueron correlacionadas las características radiológicas sugestivas de agresividad-recurrencia y/o malignidad con el grado y tipo histológico definitivo. En los estudios de imágenes se evaluó localización de los tumores diferenciándolos entre tumores de base de cráneo y otros (meningiomas de la convexidad, parasagitales, de la hoz y tentoriales), tipo de realce (homogéneo: intensidad con relación de semejanza y uniformidad en todo el volumen de la lesión en estudio; heterogéneo: intensidad sin relación de semejanza y uniformidad en todo el volumen de la lesión en estudio), presencia y magnitud de edema vasogénico, cavidades quísticas, lisis o invasión craneal, extensión secundaria a la base de cráneo, hiperostosis adyacente, calcificaciones amorfas y coeficiente de difusión aparente (ADC).
Análisis estadístico
Los datos son presentados como porcentaje, media ± desvío estándar. Las comparaciones se realizaron con T Test, acorde a la distribución y para las variables categóricas se utilizó el test del Chi cuadrado. Se utilizó correlación de Pearson para demostrar la relación entre Ki67 y el ADC. Se consideró significativa una p< 0.05. Para el análisis se utilizó el programa STATA 15
RESULTADOS
Durante el período estudiado fueron intervenidos quirúrgicamente 56 pacientes con una edad promedio de 55 ± 10 años con diagnóstico de meningioma, 45% eran de sexo masculino. Todos los pacientes con diagnóstico de meningioma fueron incluidos en el trabajo.
Se consideraron de bajo grado 39 (70%) y alto grado 17 (30%). Del último grupo, 9 (16%) fueron grado II y 8 (14%) grado III.
Cuando se compararon los pacientes de bajo y alto grado podemos observar que en el segundo grupo había una mayor proporción de pacientes masculinos (33% vs 71%, p 0,01). (Tabla 1).
Tabla 1. Comparación de meningiomas de bajo y alto grado. ADC, Coeficiente de difusión aparente
|
Bajo Grado=39 |
Alto Grado=17 |
P |
Realce heterogéneo |
9 (23%) |
9 (53%) |
0.028 |
Edema Vasogénico |
20 (51%) |
10 (59%) |
0.60 |
Cavidades quísticas |
5 (13%) |
5 (29%) |
0.14 |
Lisis o invasión craneal |
12 (31%) |
4 (24%) |
0.58 |
Extensión a la base del cráneo |
6(15%) |
2 (12%) |
0.72 |
Hiperostosis |
8 (21%) |
4 (24%) |
0.8 |
Calcificaciones |
11 (28%) |
4 (24%) |
0.71 |
Ki 67 |
1.8% (±0.9) |
7.29% (±10.8) |
0.002 |
ADC |
0.91 (±0.2) |
0.39 (±0.19) |
0.00001 |
Masculino |
13 (33.3%) |
12 (70.59%) |
0.01 |
Localización fuera de la base de cráneo |
23 (58.97%) |
11 (64.71%) |
0.87 |
En los estudios de imágenes se pudo observar que en los tumores de alto grado se presentaron mayormente con lesiones quísticas y en la convexidad, aunque estos resultados no fueron estadísticamente significativos. Con el resto de las observaciones: localización fuera de la base de cráneo, presencia de edema vasogénico, lisis o invasión craneal, hiperostosis y calcificaciones no se evidenciaron diferencias.
Los pacientes de alto grado tuvieron mayor realce heterogéneo (53% vs 23%, p 0.028) y menor valor de ADC (0.92 vs 0.39, p 0.00001). (Tabla 1 y 2).
No se puede realizar un análisis multivariable por ser una muestra pequeña.
Se observó una correlación inversa entre Ki 67 y ADC (R2 = 0,20, p <0,0001). En el control anual de los pacientes no se observó presencia de recidiva.
DISCUSIÓN
Los estudios por imágenes como la RM y la TC han contribuido a mejorar el diagnóstico y el tratamiento de los meningiomas.
Los meningiomas se ven generalmente como una masa circunscrita, homogénea y anclada a la duramadre con un fuerte realce luego del contraste endovenoso. De manera infrecuente, también pueden exhibir ciertas características que sugieren agresividad. El objetivo de este trabajo fue examinar si esas imágenes atípicas se correlacionan con los grados histopatológicos avanzados.
Los meningiomas quísticos son relativamente poco frecuentes, entre el 1.7% a 11.7% del total de meningiomas intracraneales19–23. Se ha reportado que la frecuencia de atipia es mayor entre los meningiomas quísticos que entre los que no lo son19–23. Se han sugerido múltiples etiologías para la formación de quistes en meningiomas: rápido crecimiento, degeneración quística, secreción directa de fluido por células tumorales, necrosis isquémica y la absorción de la hemorragia dentro del tumor19,24,25. Nuestro estudio demostró que la presencia quística intratumoral fue más frecuente en meningiomas de grado II / III (29%) que en los meningiomas de grado I (13%), pero no fue estadísticamente significativa (p = 0,14).
Se pudo observar que la presencia de un realce heterogéneo está relacionada con grados más avanzados, y ocasionalmente podría estar vinculado con la presencia de quistes intratumorales, isquemia y necrosis propia del tumor.
La hiperostosis adyacente se observa con mayor frecuencia en el meningioma en placa, con una incidencia de 13% a 49%, y en sólo el 4,5% de todos los meningiomas26. En nuestra serie, observamos hiperostosis en el 21% de los meningiomas típicos y 24% de los meningiomas atípicos y malignos (p> 0,05). Se han propuesto varias teorías sobre el mecanismo de la hiperostosis, incluyendo: trastornos vasculares del hueso causados por el tumor, irritación del hueso sin invasión, estimulación de los osteoblastos en el hueso normal por factores secretados por las células tumorales, producción de hueso por el propio tumor, y verdadera invasión tumoral del hueso con destrucción ósea26–28.
Los resultados muestran que, aunque la hiperostosis y la destrucción ósea pueden reflejar verdadera invasión tumoral del cráneo, no son indicadores fiables de los grados histopatológicos avanzados.
Los meningiomas basales pueden extenderse al espacio extracraneal a través de los agujeros de la base del cráneo. Hsu y col. informaron que cinco meningiomas atípicos (31,3%) y un meningioma benigno (1,7%) se extendieron extracranealmente a través del foramen oval o del foramen rotundum29.
Pieper y col. observaron el mismo hallazgo en nueve pacientes30. La invasión tumoral del piso de la fosa media y los músculos esqueléticos se demostró histológicamente y algunos de los meningiomas también exhibieron invasión perineural (a través de la rama mandibular del nervio trigémino) o de la mucosa de la nasofaringe. Aunque todas estas características sugieren comportamiento tumoral agresivo nuestro estudio no confirmó que la extensión de tumor extracraneal sea un signo clínico de grado histopatológico avanzado. En los meningiomas generalmente hay líquido cefalorraquídeo (LCR) y aracnoides que sirven como barreras fisiológicas entre el tumor y el parénquima cerebral adyacente. Se han propuesto muchos factores en relación con el desarrollo y el grado de edema cerebral inducido por los meningiomas: el tamaño tumoral, los subtipos histológicos, la vascularización del tumor, la estasis venosa, el tipo de suministro arterial (predominio pial o dural), los receptores de hormonas sexuales, el efecto de los factores de crecimiento del endotelio vascular, la actividad secretora, la isquemia cerebral secundaria, la verdadera invasión, etc29,31–34. En nuestro estudio, el 51% de los meningiomas benignos y el 59% de los meningiomas atípicos / malignos se asociaron con edema cerebral; sin embargo, la diferencia no fue estadísticamente significativa. Estos hallazgos y las discrepancias entre los estudios podrían reflejar la combinación de varios factores (incluyendo subtipos histológicos) que contribuyen al edema cerebral peritumoral y cuya contribución relativa aún tienen que ser determinada.
Algunos autores sugieren que los meningiomas de la base del cráneo tendrían un menor riesgo de comportamiento biológico agresivo35,36. Sade y sus colegas informaron que meningiomas de la base del cráneo tienen 4 veces menor riesgo de ser atípicos o malignos en comparación con los que no se localizan en la base37. Kane et al. demostraron que los meningiomas de la convexidad o del tentorio son dos veces más propensos a ser de grado II o III38. El mecanismo que subyace a esta diferencia de riesgo puede resultar del origen embriológico distinto de la base del cráneo y sus meninges. Pese a que existe una mayor tendencia, tanto en la literatura como en nuestro estudio, a observar que las lesiones malignas eran más frecuentes en la convexidad, no resultó estadísticamente significativo.
Se ha publicado que el sexo masculino también confirió un riesgo 2 veces mayor de tener una lesión de grado II o III. A pesar de que las mujeres tienen una
mayor incidencia global de meningiomas, otros estudios también han revelado un aumento del riesgo de meningiomas atípicos y malignos asociados con el sexo masculino [35]. El mecanismo por el cual el sexo masculino aumenta el riesgo actualmente no está claro. Sin embargo, alguna explicación sobre la biología de este fenómeno apunta en la literatura hacia las diferencias en el estado de los receptores y niveles hormonales, y la variación genética de los cromosomas sexuales. El concepto de una biología tumoral distinta en asociación con el grado del tumor y una conexión con el sexo está apoyado por la evidencia que demuestra que los meningiomas benignos tienen un alto nivel de expresión del receptor de progesterona en relación con los estudios clínicos e histopatológicos y los meningiomas atípicos y malignos han mostrado una relación inversa con el nivel de expresión del receptor de progesterona39,40.
En nuestra investigación las lesiones de alto grado pertenecieron en un 70,59% a los varones, correlacionando con lo publicado en la literatura.
Basándonos en la hipótesis de que la difusión de agua hacia y desde las células depende de la relación entre el espacio intracelular y extracelular, las secuencias de difusión y coeficiente de difusión aparente (ADC) permitirían diferenciar los grados tumorales41.
Los meningiomas de alto grado se caracterizan por un aumento de la celularidad del tumor, aumento de la relación núcleo/ citoplasma, presencia de células pequeñas, y el aumento de mitosis, lo que limita la difusión del agua, que se visualiza como hiperintensidad en difusión [42,43]. En el cálculo del valor de ADC pudimos observar una correlación inversa entre Ki 67 (directamente proporcional al grado tumoral) y el ADC (R2 = 0,20, p <0,0001), coincidiendo con algunos estudios publicados 44,45.
CONCLUSIÓN
El objetivo de este trabajo fue evaluar e identificar características de las imágenes prequirúrgicas en conjunto con otras variables que permitan predecir un comportamiento tumoral agresivo.
El conocimiento anticipado del grado tumoral permitiría tomar mejores decisiones quirúrgicas y disminuir la morbimortalidad de los pacientes, ya sea manteniendo una conducta expectante en lesiones aparentemente benignas o siendo más agresivos con lesiones asintomáticas que podrían tener un alto potencial de malignidad.
Pudimos corroborar que variables como el sexo masculino, realce heterogéneo y un índice de ADC bajo son sugestivas de lesiones de alto grado. Podríamos agregar que en las lesiones quísticas y de la convexidad, a pesar de no haber hallado una diferencia estadísticamente significativa en este estudio, el porcentaje de tumores agresivos fue mayor, coincidiendo con la literatura.
Fuentes de financiación: Ninguna.
Conflicto de intereses: Ninguno para declarar.
Agradecimientos: No aplica.
BIBLIOGRAFÍA
COMENTARIO
Los autores analizaron una serie de casos de meningiomas operados para encontrar características imagenológicas que permitan predecir el grado histológico de dichos tumores. Este estudio tiene una gran importancia en la práctica diaria de todo neurocirujano.
Ellos encontraron que el realce heterogéneo y el bajo valor de ADC se relacionan más frecuentemente en los meningiomas de grado 2 y 3 según la clasificación de la Organización Mundial de la Salud.1 Esto se corresponde con lo descripto en un reciente metaanálisis publicado.2 Dicho metaanálisis incluyó todos los artículos que describen las características imagenológicas hallados en resonancias magnéticas (RM) de meningiomas intracraneales. El meta-análisis concluyó que la presencia de un realce heterogéneo y características quísticas son predictores de mayor grado histológico.3-5 Seguramente futuros trabajos prospectivos brindarán una mejor evidencia para confirmar dichos hallazgos.
Felicito a los autores por este importante aporte para nuestra práctica diaria.
Yasuda Ezequiel
Hospital de Clínicas "José de San Martín" CABA, Argentina
COMENTARIO
Los autores describen una serie de meningiomas con interés en aspectos (de género e imágenes) con potencial de representar marcadores de agresividad y grado histológico. El interés de este conocimiento se basa en la posibilidad de ajustar mejor las estrategias terapéuticas acorde a cada caso en particular, reduciendo la morbimortalidad y optimizando la sobrevida y evolución. Si bien los resultados mostraron sólo significancia estadística predictora de meningiomas grado II y III al género masculino, el patrón heterogéneo de captación del contraste y la caída en el mapa de ADC, otras variables como la localización en la convexidad, presencia de quistes, edema, remodelación ósea o calcificaciones no reflejaron sólidamente una diferencia distintiva que ayude a predecir algún grado en particular. Es interesante la referida presencia de caída en el mapa de ADC, que suele ir de la mano de brillo en la difusión, característico y diagnóstico de áreas de necrosis en lesiones meníngeas grado III. Predecir el grado histológico es útil para la conversación preoperatoria con el paciente y los familiares, y en aquellos grupos reducidos de pacientes que por edad avanzada o comorbilidades no toleren la cirugía (situación cada vez más infrecuente considerando la aceptable morbimortalidad de las técnicas neuroquirúrgicas modernas). De acuerdo con los autores, seguiremos leyendo y esperando futuros aportes sobre predictores de grado histológico en esta patología.
Tomás Funes
Sanatorio Anchorena. Ciudad Autónoma de Buenos Aires