Presentación de un nuevo equipo de neuronavegación con brazo robótico. Estudio preliminar en 4 casos quirúrgicos pediátricos
Jorge Beninca, Edgardo Morsucci, Lucas Vera, Anabella Gatti
Hospital de Niños “Dr. Orlando Alassia”, Santa Fe, Argentina
Recibido: 13/01/2025 Aceptado: 09/05/2025
Jorge Beninca
jorgebeninca@gmail.com
DOI: 10.59156/revista.v0i0.684
ORCID
Jorge Beninca: 0009-0007-7799-4137
Edgardo Morsucci: 0009-0002-7126-4682
Lucas Vera: 0009-0002-2775-5588
Anabella Gatti: 0009-0002-3270-681X
EMAILS
Edgardo Morsucci: edgardo.morsucci@gmail.com
Lucas Vera: vera_lucas@live.com
Anabella Gatti: draanagatti@gmail.com
Los autores no declaran conflicto de interés
Los autores no declaran financiamiento.
Este es un artículo de acceso abierto bajo la licencia CC BY-NC https://creativecommons.org/licenses/by-nc/4.0/
RESUMEN
Introducción: en las cirugías estereotácticas y de neuronavegación, las imágenes en 3D del cerebro humano se utilizan como un mapa virtual y un dispositivo físico que identifica las estructuras anatómicas en el cerebro real. El desarrollo tecnológico ha avanzado desde los dibujos y fotografías de cerebros cadavéricos hasta las representaciones tridimensionales en tiempo quirúrgico, desde los dispositivos mecánicos estáticos hasta los sistemas visuales y magnéticos instantáneos.
Objetivo: presentar la experiencia inicial del uso de un dispositivo de neuronavegación con brazo robótico desarrollado por los autores.
Descripción del instrumental: se trata de un sistema físico de localización tridimensional y el software correspondiente, diseñado para uso en intervenciones neuroquirúrgicas como herramienta de neuronavegación que adquiere datos, tanto de imágenes por resonancia magnética (RM) como de la tomografía axial computada (TAC). Entrega, con una frecuencia de 5/segundo, 3 datos de posición de la punta del marcador (lápiz) que corresponden a los valores en el eje X con una precisión de menos de 0.12 mm, una precisión del eje Y de menos de 0.23 mm y, para el eje Z, una precisión de 0.14 mm. Además, la misma información incluye los 3 ángulos de rotación del vector del lápiz marcador en tiempo real.
Conclusión: el equipo testeado en los cuatro casos resultó sencillo de usar y efectivo para neuronavegar y trazar la ruta de aproximación al blanco.
Palabras clave: Abordaje. Brazo robótico. Neuronavegación. Software
Presentation of a new robotic arm neuronavigational device. Preliminary study in 4 pediatric surgical cases
Background: in stereotactic and neuronavigational surgeries, 3D medical images of the human brain are used as a virtual map and a physical device that pinpoints anatomical structures in the real brain. Technological development has advanced from drawings and photographs of cadaveric brains to three-dimensional representations in surgical time and, in localization systems, from static mechanical devices to instantaneous dynamic visual and magnetic systems.
Objective: to present the initial experience of using a neuronavigational device with a robotic arm developed by the authors.
Device description: it is a physical three-dimensional localization system and the corresponding software, designed for use in neurosurgical interventions as a neuronavigational tool that acquires data from both Magnetic Resonance Imaging (MRI) and Computed Tomography (CT). It delivers, with a frequency of 5/second, 3 position data of the marker tip (pencil) that corresponds to the values on the X axis with an accuracy of less than 0.12 mm, Y axis accuracy of less than 0.23 mm and, for the Z axis an accuracy of 0.14 mm. In addition, the same information includes the data of the 3 angles of rotation of the marker pencil vector.
Conclusion: the equipment tested in four cases was simple to use and effective for marking and tracing the approach routes to the target.
Keywords: Approach. Neuronavigational. Robotic Arm. Software
INTRODUCCIÓN
La correspondencia entre la anatomía de un volumen cerebral y su representación gráfica en un mapa tridimensional (atlas, TC, RM), mediante un dispositivo que obtenga las coordenadas, es la base conceptual para el desarrollo de la estereotaxia y la neuronavegación.1-3
En una línea histórica sucinta, hacia principios del siglo XX se utilizaron aparatos fijados sólidamente al cráneo y, a través de ejes longitudinales y radiales de metal, con una punta marcadora se obtenían las coordenadas geométricas que se trasladaban a los mapas o imágenes de las estructuras anatómicas correspondientes en un paciente dado.4,5 Luego estas mediciones se hicieron móviles, en forma analógica o digital de los ángulos y brazos, permitían los registros de las coordenadas. Más tarde, las mediciones se calculan visualmente por estereoscopia con cámaras de precisión y marcadores fijos y móviles, que entregan la misma información.6-8 Los dispositivos magnéticos trabajan por alteración de campos en el mismo espacio quirúrgico.9,10 Hay también mixtos, magnéticos/visuales, con funcionamiento combinado.
La mejora en la precisión y homogeneidad en los actuadores físicos que miden los ángulos y el desarrollo de programas y velocidades de cómputo de las últimas décadas nos instaron a considerar la posibilidad de hacer un paso atrás en esa línea y plantear la posibilidad de utilizar nuevamente un sistema físico.9-11
La definición espacial y la velocidad de obtención de los datos del mundo físico con un brazo robótico como los que se obtienen comercialmente en la actualidad y la existencia de plataformas de gráficas de imágenes médicas tridimensionales, permitieron desarrollar un neuronavegador con buena precisión y calidad en la presentación visual.
DESCRIPCIÓN DEL INSTRUMENTAL Y PROCEDIMIENTO
Se ha adaptado un dispositivo de medición en 3 dimensiones al uso en un ambiente de quirófano (MicroScriber®);9 este entrega, con una frecuencia de 5/segundo, 3 datos de posición de la punta del marcador (lápiz) que corresponden a los valores en el eje X con una precisión menor a 0.12 mm, en el eje Y con precisión menor a 0.23 mm y, para el eje Z, una precisión de 0.14 mm. Además, en la misma información, se incluyen los datos de los 3 ángulos de rotación del vector del lápiz marcador. La aplicación de este sistema se realizó en cuatro casos seleccionados en los que las técnicas convencionales también permitieran el tratamiento quirúrgico sin poner en riesgo al paciente.
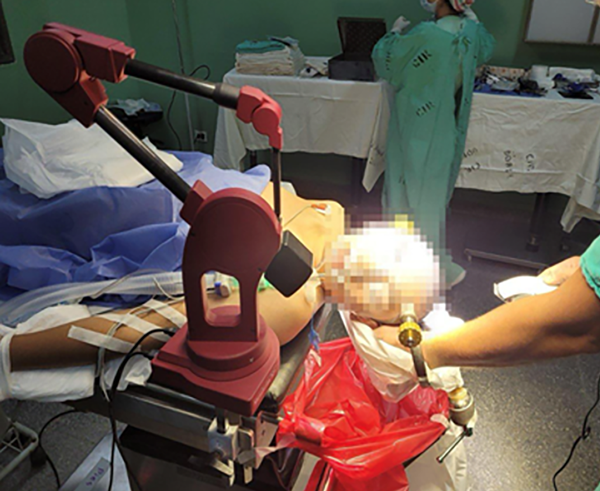
El sistema es protegido en el quirófano por una manga estéril de polietileno. El pin de aluminio, único contacto físico con el paciente, se esteriliza con los métodos habituales y se coloca en el brazo una vez constituido el campo quirúrgico (Figura 1).

Figura 1.Tiempo prequirúrgico. Fijación del cráneo y ubicación del brazo robótico.
Los datos son enviados a una computadora en la misma sala de operaciones que, mediante un software escrito por los autores, los procesa en una gráfica tridimensional y permite marcar la posición y rotación del lápiz lector en una pantalla de visualización. El brazo robótico se fija a la mesa quirúrgica y al marco de Mayfield mediante un sistema de prensas solidarias entre sí. Se ubica siempre al lado del hombro izquierdo del paciente. En la cirugía de columna, con el paciente en decúbito prono, se colocó a la altura del tórax del lado izquierdo.
Una sesión se realiza en dos tiempos: 1) registración que consiste en la medición de al menos cuatro puntos que se correspondan con puntos coincidentes con la tomografía de referencia. Con estos datos se calcula automáticamente la matriz de registración, que establece una correspondencia punto a punto entre mundo físico y espacio virtual. El error de registración se calcula por cuadrados mínimos y es una medida del ajuste de esa correspondencia. En un criterio práctico, lo determinamos como aceptable menor a 1 mm; si no se consigue, se realiza nuevamente este paso o se considera el uso de un método automático de corrección de errores. Este paso se hace antes de la colocación de los campos quirúrgicos.
2) Medición propiamente dicha: el sistema grafica un objeto que representa al lápiz del brazo en las imágenes del paciente. Se puede visualizar en 3D y en cortes bidimensionales MPR. Cuenta con una proyección, de distancia programable, para estimar dónde estaría la punta de una herramienta (cánula de biopsia, endoscopio, catéter) si se apoya el lápiz en la superficie cefálica. La frecuencia de actualización de la lectura es de 5 veces por segundo. Las mediciones se hacen en el tiempo quirúrgico que requiere el uso de un pin estéril que se rosca luego de cubrir al brazo con una manga de polietileno estéril (Figura 2).
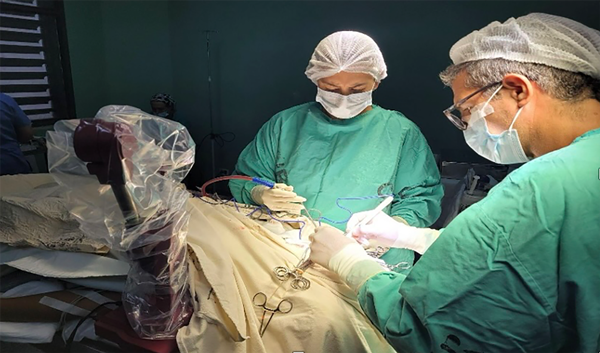
Figura 2. Brazo robótico en tiempo quirúrgico.
Los cálculos, los modelos y las imágenes de TAC, MR, o fusión de ambas, son procesados por la plataforma 3D Slicer.11 Toda la gestión de la representación del espacio virtual queda a cargo de esta.
Tratamiento matemático: en un trabajo previo12 se desarrollaron las ecuaciones en un programa para ubicar en un marco estereotáxico Micromar® las coordenadas y la trayectoria de una aguja de biopsia, según su sistema de fiduciarios. En el núcleo del cálculo se encuentra la ecuación general transformada (Figura 3).
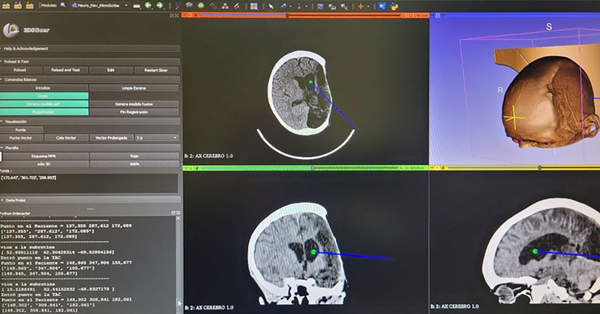
Figura 3. Caso 4. Trazado de trayectoria para colocación de catéter ventricular.
Esta matriz permite representar las 3 dimensiones de un punto en la entrada física del dispositivo lector en el mismo espacio virtual de una imagen médica y un modelo que represente el lápiz o una herramienta adosada a este, por ejemplo: una cánula de endoscopia. La lógica geométrica es la misma que tienen los controladores de un aeropuerto de la posición de un avión en despegue, y sus rotaciones se definen (y tienen los mismos nombres: cabeceo, dirección y rolido) que los de este sistema virtual. Esta ecuación además permite que cada modelo y cada imagen puedan ser movidas, rotadas, ampliadas o deformadas, según parámetros específicos para visualizar las estructuras anatómicas de cada paciente para la planificación de una cirugía. En el modo de registración se requiere el mejor ajuste posible entre lectura real y representación. Para reducir el error se utiliza un cálculo: el algoritmo de punto más cercano iterativo (Iterative Closest Point, ICP), que ajusta con el cuadrado del número de datos, por lo que, aunque el número mínimo es de 4 puntos, es preferible una cantidad mayor de puntos correspondientes.13
CONCLUSIONES
Se ha diseñado y construido un sistema de navegación para cirugías neurológicas que utiliza puntos óseos o estructuras cutáneas o marcadores fijados solidariamente al cráneo para la localización tridimensional. Este proyecto se encuentra en la fase de prototipo. Se han realizado pruebas en laboratorio y en el quirófano en situación quirúrgica. En todos los casos, el uso del sistema de neuronavegación fue a los efectos de corroborar su eficacia y sin que el procedimiento quirúrgico dependiera de este ya que se trata de una experiencia inicial. La evaluación en el laboratorio se ha hecho con impresiones 3D de TACs de pacientes efectivamente operados, en el departamento de bioingeniería de la Universidad Nacional de Entre Ríos (UNER) y la evaluación en el quirófano se hizo cualitativamente por la opinión de los cirujanos involucrados en cada cirugía, todos del servicio de Neurocirugía del Hospital de Niños “Dr. Orlando Alassia” de la ciudad de Santa Fe. En los cuatro casos empleados, el sistema arrojó prestaciones satisfactorias y acorde a las simulaciones. Las mediciones estadísticas de precisión, repetibilidad y seguridad bioeléctrica son objeto de otra publicación, actualmente en proceso.
El registro del volumen del cráneo y cerebro del paciente en el espacio virtual de referencia de tomografía, o de fusión de estas con imágenes de RM permite la localización de la estructura anatómica con precisión.14,15 La geometría angular utilizada es equivalente a la de la aeronavegación y de allí toma su desarrollo matemático y las definiciones en las formas, traslaciones y rotaciones. La precisión de la tecnología robótica y computacional utilizada en este proyecto depende de la calidad del sistema de captación espacial. En este prototipo se encuentra por debajo de la décima de milímetro, según se informa en el manual de usuario del brazo robótico utilizado, por lo que se plantea como una alternativa viable en neurocirugía.
Consideramos que los bajos costos de fabricación por la incorporación de software libre y la exactitud del sistema hacen factible que, en un futuro cercano, la comunidad de neurocirujanos pueda adoptar esta tecnología en su práctica.
Agradecimientos: al Dr. Mario Jaikin y al programador Ricardo Burone por sus aportes desinteresados a este trabajo.
Contribuciones de autoría
Conceptualización, Análisis formal, Investigación, Metodología, Administración del proyecto, Redacción - borrador original y Redacción - revisión y edición: Jorge Beninca. Curación de datos y Visualización: Jorge Beninca, Anabella Gatti, Edgardo Morsucci, Lucas Vera. Validación: Jorge Beninca, Edgardo Morsucci, Lucas Vera. Recursos: propios. Software: Dpto. de Bioingeniería de la Universidad Nacional de Entre Ríos.
BIBLIOGRAFÍA
COMENTARIO
En la historia de la neurocirugía, la importancia en valoración y mensuración volumétrica, con su visión tridimensional, ha sido y es importante en el abordaje quirúrgico de las patologías del sistema nervioso central. En las últimas décadas los avances e innovaciones en instrumental, imágenes, microscopio para el desarrollo de la microcirugía, la física, ingeniería y robótica aportaron mucho y hacen que los eventos quirúrgicos sean más precisos, más efectivos y menos invasivos.
Los conceptos estereotáxicos juegan un papel muy importante en esto que describimos, y la neuronavegación es de gran aporte.
En referencia a este artículo debo decir que se han guiado en la construcción de este prototipo desde las bases claras de la estereotaxia, valorando las referencias que toman, donde algunas no tienen seguridad de fijación con respecto a las imágenes obtenidas y los elementos de corrección físico-espaciales adecuados, y que además han sido chequeadas con respecto a sistemas estereotácticos tradicionales y validados.
Por último, también remarcar la simplificación del sistema y sus costos, lo que lo hace sumamente atractivo y útil para ser empleado en sistemas de salud donde los presupuestos son bajos. Este equipo de neuronavegación puede ayudar y brindar una neurocirugía acorde a lo que demandan los tiempos actuales.
Felicito a los autores por este diseño y prueba de prototipo, y como bien se enuncia en su descripción, debe continuar cumpliendo las etapas necesarias para la validación médica.
Carlos Alberto Ciraolo
Servicio de Neurocirugía Adultos y Pediatría, Jefe de Sección de Neurocirugía Funcional, Hospital Italiano de Buenos Aires