Evaluación de la plasticidad cerebral en pacientes con transferencia hipogloso-facial: análisis de 70 casos
Martín Emilio Bourguet, Mauro Biancardi, Tomás Alfonso Badilla Campos, Federico Eduardo Minghinelli, Brenda Iglesias, Mariano Socolovsky
División Neurocirugía, Hospital de Clínicas “José de San Martín”, Universidad de Buenos Aires, Ciudad Autónoma de Buenos Aires, Argentina
Martín Emilio Bourguet
martin.bourguet@hotmail.com
Recibido: 01/07/2024. Aceptado: 20/08/2024
DOI: 10.59156/revista.v38i03.663
ORCID
Martín Emilio Bourguet: 0000-0002-7304-5010
Mauro Biancardi: 0009-0003-5400-6176
Tomás Alfonso Badilla Campos: 0009-0005-9902-5543
Federico Eduardo Minghinelli: 0000-0002-7448-5456
Brenda Iglesias: 0000-0002-5481-7003
Mariano Socolovsky: 0000-0002-0667-3463
EMAILS
Mauro Biancardi: biancardimauro97@gmail.com
Tomás Alfonso Badilla Campos: tomasbadilla@campus.fmed.uba.ar
Federico Eduardo Minghinelli: minghinelli.f@gmail.com
Brenda Iglesias: breniglesiasbi@gmail.com
Mariano Socolovsky: marianosocolovsky@gmail.com
Los autores no declaran conflicto de interés
Los autores no declaran financiamiento.
RESUMEN
Introducción: la plasticidad cerebral es clave para recuperar el control volitivo independiente de los músculos de la mímica luego de una anastomosis hipogloso-facial (AHF), de manera que el movimiento de la lengua no genere movimientos sincrónicos de la cara.
Objetivos: evaluar la plasticidad cerebral mediante el empleo de la escala de plasticidad (PGS).
Materiales y métodos: se evaluaron 70 pacientes luego de una AHF en dos pasos: 1) usando el comando del nervio donante, es decir moviendo la lengua, y 2) activando el músculo de la mímica, evitando conscientemente el uso del comando motor del nervio hipogloso. Se utilizó una escala de plasticidad (PGS) de 4 puntos para evaluar el control voluntario.
Resultados: 29 pacientes obtuvieron un PGS de 1; 37, un PGS de 2; 4, un PGS de 3 y ninguno alcanzó un PGS de 4. Se observó una relación negativa significativa (p <0.01) entre la edad y la plasticidad cerebral, lo que implica que, a mayor edad, menor plasticidad. También se encontró una relación positiva significativa (p <0.05) entre la calidad/frecuencia de la rehabilitación motora y la plasticidad cerebral, sugiriendo que una mejor rehabilitación se asocia con mayor plasticidad.
Conclusión: luego de la evaluación, se observó que la edad tiene una relación negativa y la calidad/frecuencia de la rehabilitación una relación positiva con la plasticidad cerebral. Sin embargo, ningún paciente alcanzó la plasticidad necesaria para un control voluntario independiente y completo.
Palabras clave: Hipogloso. Nervios periféricos. Parálisis facial. Plasticidad
Evaluation of brain plasticity in patients with hypoglossal-facial nerve transfer: analysis of 70 cases
ABSTRACT
Background: brain plasticity is crucial for regaining independent volitional control of facial muscles following hypoglossal-facial (HF) anastomosis, ensuring that tongue movements do not induce synchronous facial movements.
Objective: to evaluate brain plasticity using the Plasticity Grading Scale (PGS).
Methods: seventy patients were evaluated after an HF anastomosis: 1) using the donor nerve program, i.e., moving the tongue, and 2) activating the mimic muscle, consciously avoiding the use of the donor nerve. A 4-point Plasticity Grading Scale (PGS) was used to assess voluntary control.
Results: 29 achieved a PGS of 1; 37 a PGS of 2; 4 a PGS of 3, and none reached a PGS of 4. A significant negative relationship (p <0.01) was observed between age and brain plasticity, implying that older age is associated with lower plasticity. A significant positive relationship (p <0.05) was also found between the quality/frequency of motor rehabilitation and brain plasticity, suggesting that better rehabilitation is associated with greater plasticity.
Conclusion: brain plasticity was evaluated in 70 patients’ post-HF anastomosis. Age was negatively correlated, and the quality/frequency of rehabilitation was positively correlated with brain plasticity. However, no patient achieved the plasticity necessary for complete and independent voluntary control.
Keywords. Facial Paralysis. Hypoglossal. Peripheral nerves. Plasticity
INTRODUCCIÓN
La parálisis facial es una entidad frecuente en la población mundial (20 cada 100000 personas), de estos, 127000 casos presentan parálisis facial irreversibles.1–3 Si bien existen múltiples causas, la más frecuente comprende etiología idiopática, la que constituye el 70% de las parálisis faciales. Además, existen otras causas entre las que se destacan la parálisis facial traumática o iatrogénica, esta última, secundaria a resecciones tumorales (ej. schwannomas del VIII par craneal), lo que representa un 20-25% de los casos.4-7
La afectación de dicho nervio produce alteraciones en la protección ocular, la continencia oral, la deglución y un déficit en la expresión facial que implican un trastorno en términos estéticos, funcionales y sociales, con consecuencias devastadoras en la calidad de vida.8,9
Clásicamente, se han descripto múltiples técnicas quirúrgicas como parte del tratamiento de la parálisis facial en casos seleccionados, entre estas se destacan las transferencias nerviosas que han sido ampliamente utilizadas con el objetivo de recuperar la inervación y función de los músculos faciales y de esta manera mejorar la calidad de vida de los pacientes.10,11 Estas transferencias se emplean únicamente cuando el cabo proximal del nervio facial no es viable para su reconstrucción. En contraste, cuando este sí es viable para su reconstrucción, con o sin injerto interpuesto, constituye siempre la primera elección para su reparación.12,13
Antes de cualquier transferencia, el nervio donante está conectado a un comando motor original del sistema nervioso central (SNC) para movimientos especializados, un conjunto de funciones y secuencias aprendidas y almacenadas en el cerebro a lo largo del tiempo. Estas responden a un comando específico para ejecutar una función, permitiendo al paciente activar un músculo determinado.14 Por ejemplo, el nervio hipogloso responde a un comando para movimientos voluntarios de los músculos de la lengua, con el fin de mover ese órgano. Cuando este nervio se transfiere y se conecta al nervio facial para recuperar la movilidad, el comando motor central de la lengua se conecta a los músculos faciales. Esto puede generar movimientos deseados que constituyen el objetivo de la cirugía, pero también puede generar otros indeseados de los músculos faciales al desencadenar el movimiento de la lengua, por ejemplo, durante la deglución.15
Posterior a una transferencia nerviosa se desencadenan múltiples cambios a nivel central relacionados con la readaptación y reeducación cortical. Este fenómeno de adaptación cortical ante los estímulos internos y externos es lo que conocemos con el nombre de neuroplasticidad y es esencial para obtener el control voluntario del músculo objetivo después de una transferencia nerviosa.16 Si este proceso de transición/neuroplasticidad es incompleto, el control voluntario independiente del paciente sobre sus funciones musculares restauradas también será incompleto.14 Por ejemplo, el resultado funcional después de una transferencia del nervio hipogloso al nervio musculocutáneo es limitado porque la restauración del control voluntario independiente es pobre. La flexión voluntaria del codo solo puede iniciarse cuando la lengua se empuja contra el paladar duro, y la flexión se pierde tan pronto como el paciente comienza a hablar. Además, la contracción involuntaria del bíceps ocurrirá durante los movimientos de la lengua asociados con la alimentación. Por lo tanto, luego de esta transferencia, la desconexión del nervio hipogloso de sus raíces en el SNC es insuficiente. En consecuencia, el nervio hipogloso ya no es considerado un donante viable durante la cirugía reconstructiva del plexo braquial.17
Por el contrario, el nervio hipogloso constituye una primera línea al seleccionar un donante para reinervar la cara cuando una reparación directa del nervio facial no es factible. Probablemente, el hecho de que la corteza motora de los músculos faciales esté cerca de la lengua, y considerando también que sus movimientos son espontáneamente sincrónicos con los movimientos faciales, podemos esperar que cuando el paciente reanimado facialmente hable, también mueva la cara reinervada, creando así una apariencia natural del movimiento. Contrariamente a esto, cuando la cara está en reposo, y la lengua se empuja contra el paladar duro –activando la corteza motora del hipogloso– se observa frecuentemente un movimiento no deseado (es decir, cierre ocular).10
Estudios recientes cuantificaron los cambios plásticos centrales subyacentes al cambio de control voluntario en pacientes con lesiones del plexo braquial después de una transferencia nerviosa. Para ello, se utilizó una escala de clasificación de plasticidad de cuatro grados (PGS). El análisis mostró que más del 80% de los pacientes no desarrollaron una independencia completa del comando motor del donante.18
Teniendo en cuenta esto, se realizó una revisión de la literatura y se observó que, hasta el momento, nunca se han evaluado y cuantificado los cambios plásticos centrales que subyacen a una anastomosis hipogloso-facial (AHF) como parte del tratamiento en pacientes con parálisis facial.
OBJETIVOS
El presente estudio tiene como objetivo evaluar por primera vez la plasticidad cerebral posterior a una anastomosis hipogloso-facial. Para ello, se utilizó una escala de plasticidad (PGS) para evaluar el grado en que el comando del nervio donante, hipogloso, se desconectó, y los músculos faciales respondieron a su comando original. Además, se analizó si el grado de desconexión y reconexión se correlaciona con la edad del paciente, el intervalo de tiempo entre el trauma y la cirugía, la duración del seguimiento (tiempo entre la cirugía y el momento en que se evaluó nuestro PGS final) o la calidad/frecuencia de la rehabilitación fue evaluada con la Escala de Calidad de Rehabilitación de 4 puntos (RQS, las siglas por su nombre en inglés).19
MATERIALES Y MÉTODOS
Se evaluaron aquellos pacientes con parálisis facial completa (House-Brackmann VI) que fueron sometidos a una AHF. El procedimiento estuvo a cargo de la sección de Nervios Periféricos de la División de Neurocirugía del Hospital de Clínicas “José de San Martín” en el período comprendido entre el 1 de enero del 2012 hasta el 31 de junio del 2023.
Se incluyeron en nuestro análisis a aquellos pacientes cuya transferencia había sido realizada al menos 12 meses antes de la evaluación final. Se excluyeron a aquellos cuyo seguimiento no fue posible, o con un intervalo entre la parálisis facial y la cirugía mayor a 12 meses, eliminando de esa manera cualquier resultado que pudiera ser generado por el retraso en el tratamiento.
Todas las evaluaciones de los pacientes siguieron un protocolo de examen predeterminado de dos pasos. En el paso 1, se les pidió que activaran al máximo los músculos objetivos (músculos faciales), accionando solo el comando motor del nervio donante (hipogloso). Es decir, se pidió a los pacientes que presionaran la lengua contra el paladar duro al máximo y se evaluó el grado de movimientos faciales que presentaban. En el paso 2, se les solicitó que activaran al máximo comando motor del músculo objetivo (músculos faciales) tratando de no accionar el comando motor del nervio donante. De manera que se les pidió que frunzan el ceño o sonrían, mientras mantenían la lengua relajada.
Se utilizó una escala de graduación de plasticidad modificada de 4 puntos (PGS) para determinar el nivel de desconexión del nervio donante de su comando original del SNC y la reconexión al comando central de los músculos faciales.18 El PGS original fue ligeramente modificado para ser aplicable a las transferencias HF (Tabla 1). Se asignó un grado de PGS 1 (baja plasticidad cerebral) a los pacientes si, durante el paso 1, los músculos faciales se contraían claramente tras la activación máxima del comando motor del nervio donante (hipogloso) y si, durante el paso 2, no se observaba ninguna contracción de los músculos faciales tras solo la activación del comando motor del nervio facial. Esto significa que se asignó un grado de PGS 1 si se observó un cierre completo del ojo y/o una ligera asimetría del movimiento de la boca tras la activación del comando motor del donante, pero no se advirtió ningún movimiento del músculo facial tras solo la activación del comando motor del receptor. Se asignó una puntuación PGS de 2 si, tras la activación del comando del donante, se observó un cierre incompleto del ojo y/o una debilidad obvia, pero no desfigurante, del movimiento de la boca. Se asignó un grado de PGS de 3 si se encontraba un movimiento apenas perceptible del párpado o de la boca durante el paso 1, y para un grado de PGS de 4, si no se observaban movimientos. Mientras tanto, tras el comando del músculo objetivo para los grados PGS 2-4, el ojo se cierra y/o la boca se mueve en el lado afectado.
TABLA 1. ESCALA DE CLASIFICACIÓN DE PLASTICIDAD PARA TRANSFERENCIAS NERVIOSAS
Grado |
Contracción del músculo objetivo ↔ Activación del comando motor |
Respuesta en el músculo objetivo tras la orden del DONANTE (hipogloso: empujar la lengua contra el paladar duro) |
Respuesta en el músculo objetivo tras la orden del RECEPTOR (intentar contraer conscientemente todos los músculos faciales del lado afectado) |
1 |
Exclusivamente donante (sin plasticidad) |
Cierre completo del ojo y/o leve asimetría del movimiento de la boca |
Sin movimientos |
2 |
A través del donante y receptor (poca plasticidad) |
Cierre incompleto del ojo y/o debilidad evidente pero no desfigurante del movimiento de la boca |
El ojo se cierra y/o la boca se mueve en el lado afectado |
3 |
Sutil a través del donante, predominantemente a través del receptor (buena plasticidad) |
Movimiento del párpado o la boca apenas perceptible |
El ojo se cierra y/o la boca se mueve en el lado afectado |
4 |
Exclusivamente receptor (excelente plasticidad) |
Sin movimiento |
El ojo se cierra y/o la boca se mueve en el lado afectado |
También evaluamos el cumplimiento del paciente con la terapia de rehabilitación utilizando la Escala de Calidad de Rehabilitación de 4 puntos (RQS) (Tabla 2).19 Con esta escala, a cualquier paciente que no asistió a la terapia de rehabilitación, o que asistió menos de una vez por semana, se le asignó una puntuación RQS de 1; a los que recibieron terapia de rehabilitación en un centro regular más de una vez por semana se les asignó una puntuación RQS de 2; a cualquier paciente que mostrara una buena adherencia a un comando de rehabilitación en un centro de neurorrehabilitación no especializado, con evaluaciones periódicas en un centro de neurorrehabilitación especializado, se le asignó una puntuación RQS de 3. A los que mostraran una buena adherencia a un comando de rehabilitación en una institución especializada se les asignó una puntuación de RSQ de 4.
TABLA 2. ESCALA DE CALIDAD DE REHABILITACIÓN UTILIZADA PARA CUANTIFICAR LA ADHERENCIA Y LA CALIDAD DEL COMANDO DE REHABILITACIÓN POSTOPERATORIA DE UN PACIENTE
Descripción del puntaje |
1. Sin terapia de rehabilitación en absoluto o menos de una vez por semana |
2. Terapia de rehabilitación más de una vez por semana, pero no en un centro de neurorrehabilitación especializado |
3. Buena adherencia al comando completo de rehabilitación, pero no en un centro de neurorrehabilitación especializado; evaluado periódicamente en un centro de neurorrehabilitación especializado |
4. El paciente se adhiere perfectamente al comando completo de rehabilitación en un centro de neurorrehabilitación especializado |
Este estudio se realizó en total conformidad con la Declaración de Helsinki II y ambos comités de ética institucionales. Antes de su participación, cada paciente proporcionó su consentimiento informado por escrito. En el momento de la evaluación se registraron sus características demográficas, incluidos el sexo, la edad, el tiempo transcurrido desde el trauma hasta la cirugía y la duración del seguimiento.
Estrategia y técnica quirúrgica
La técnica quirúrgica implementada es la anastomosis parcial del nervio hipogloso al nervio facial.19-22 Esta implica el fresado óseo de la tercera porción del conducto facial a nivel mastoideo y su transposición hasta la región cervical superior, para su anastomosis término-terminal parcial con el nervio donante, es decir, con el 50% del nervio hipogloso. Como se mencionó, la transferencia nerviosa había sido utilizada solo cuando ningún cabo proximal del nervio facial estaba disponible para su anastomosis. (por ej., lesión del nervio facial por factura traumática del hueso temporal o resección de lesión en ángulo pontocerebeloso).
Análisis estadístico
Inicialmente, para evaluar los datos recopilados en este estudio se realizó un análisis descriptivo para caracterizar las variables de interés. Los datos continuos se informan como media (± desviación estándar) o mediana (rango intercuartil) según corresponda; mientras que los datos categóricos se informan como frecuencia (porcentaje). Se llevaron a cabo regresiones lineales utilizando el método de mínimos cuadrados ordinarios para identificar los predictores de puntuaciones más altas en la Escala de Plasticidad (PGS). Además, para analizar la relación entre variables de manera aislada se recurrió a un modelo de correlación parcial basado en la correlación de Pearson. Todos los análisis se realizaron utilizando R (R Statistical Foundation for Statistical Computing, Viena, Austria, 2021).
RESULTADOS
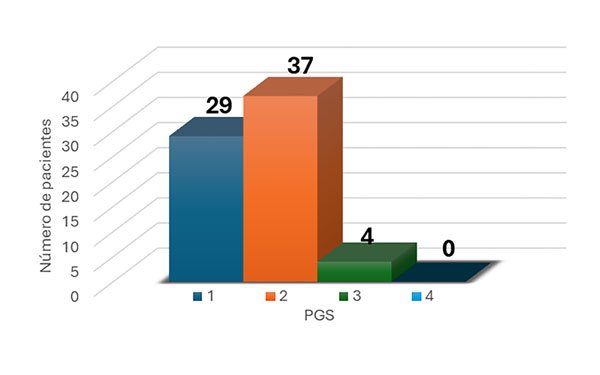
Un total de 70 pacientes fueron incluidos en este estudio. La mayoría fueron mujeres (64.3% versus 35.7%, respectivamente) y la edad media fue de 46.3 años (DE ± 16.2). El tiempo transcurrido entre el inicio de la parálisis facial y la cirugía fue una mediana de 11 meses (DE ± 4). La mediana de seguimiento de los pacientes fue de 25 meses. Considerando el total de los pacientes, la mediana del PGS fue de 1.64 (DE ± 1) y RQS mostró una mediana de 3.28 (DE ± 1) (Tabla 3). De los 70 pacientes, 29 obtuvieron un PGS 1; 37, un PGS de 2; solo 4, un PGS 3 y ninguno obtuvo un PGS de 4 (Gráfico 1).
TABLA 3. CARACTERÍSTICAS BÁSICAS
|
Hipogloso-facial (N = 70) |
Mujeres |
45 (64.3%) |
Edad |
46.3 ± 16.2 |
Tiempo del trauma a la cirugía (meses) |
11 (4) |
Tiempo de seguimiento (meses) |
25 (20) |
RQS |
3.28 |
PGS |
1.64 |
Los datos están representados como media (± desvío estándar). Mediana (rango intercuartil) o frecuencia (porcentaje).

Gráfico 1. Cantidad de pacientes clasificados según su PGS.
Al efectuar la regresión lineal y ajustar las distintas variables evaluadas (Tabla 4), se observó una relación negativa estadísticamente significativa (p <0.01) entre la edad y la plasticidad cerebral, esto indica que, a mayor edad, menor es la plasticidad cerebral (Gráfico 2). También se observó una relación positiva estadísticamente significativa (p <0.05) entre la calidad/frecuencia en la rehabilitación motora (RQS) y la plasticidad cerebral, lo que sugiere que una mayor calidad/frecuencia en la rehabilitación motora está asociada a una mayor plasticidad cerebral (Gráfico 3).
TABLA 4. CORRELACIÓN ENTRE PREDICTORES Y PGS
Regresión lineal |
|||
|
Coeficiente |
Error estándar |
Valor p |
Edad |
-0.0617 |
0.0004 |
<0.01 |
Sexo |
-0.1186 |
0.131 |
0.36 |
Tiempo del trauma hasta la cirugía |
-0.009 |
0.01 |
0.42 |
Tiempo de seguimiento |
0.004 |
0.002 |
0.15 |
RQS |
0.229 |
0.096 |
0.02 |
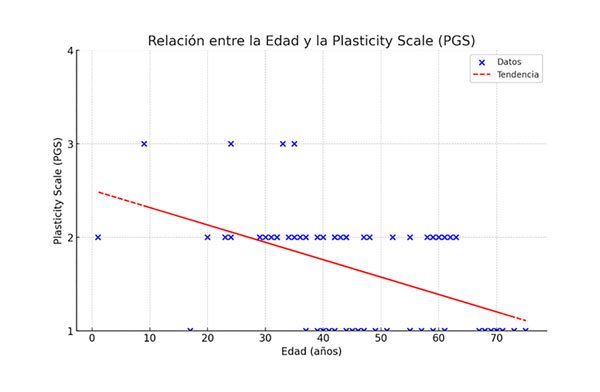
Gráfico 2. Relación entre edad y PGS.
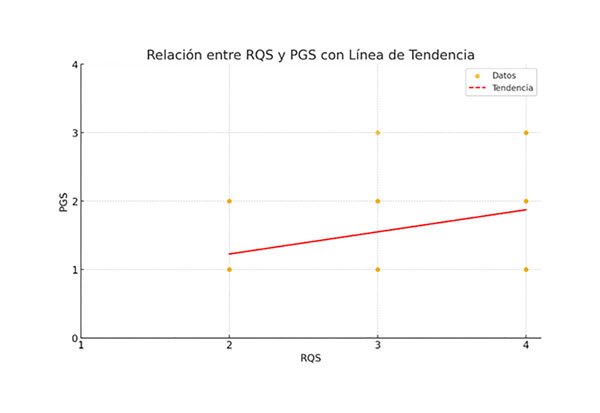
Gráfico 3. Relación entre PGS y RQS.
Además, se realizó un análisis de correlación parcial para evaluar la relación entre la Escala de Plasticidad y la RQS, controlando por la edad y el tiempo desde el trauma, es decir, aislar el efecto específico de la calidad de la rehabilitación. Los resultados indicaron una correlación positiva significativa entre la Escala de Plasticidad y la Danilo's scale (r = 0.329, p = 0.006), lo que indica que una mejor calidad de rehabilitación está asociada con una mayor recuperación de la motilidad facial, independientemente de la edad del paciente y el tiempo transcurrido desde el trauma.
DISCUSIÓN
Comúnmente se utilizan múltiples técnicas para reinervar los músculos faciales luego de una parálisis facial secundaria a una afectación quirúrgica o traumática, cuando el cabo proximal del nervio facial no se encuentra disponible.10
La técnica utilizada en este trabajo, cuando es implementada en tiempo y forma, en pacientes correctamente seleccionados, tiene una alta tasa de éxito.23 Sin embargo, hasta lo que sabemos, la independencia de los movimientos faciales con respecto al comando motor original del nervio donante (movimiento de la lengua) nunca había sido estudiada sistemáticamente en nuestra población.
Como se ha visto en otros estudios que evalúan la plasticidad neuronal posterior a distintos tipos de transferencia nerviosa en pacientes con lesión de plexo braquial,18 el proceso de neuroplasticidad central subyacente a la restauración del control voluntario independiente se ha descripto en dos procesos: (1) desconexión cortical de la función primaria del nervio donante y (2) reconexión cortical de la función primaria del nervio receptor. Estos dos procesos (de desconexión y reconexión) se pueden estudiar observando las contracciones de los músculos objetivos (músculos faciales) cuando se activa el comando motor del nervio donante (nervio hipogloso).
Hasta donde sabemos, este estudio es el primero en analizar clínicamente los cambios plásticos que ocurren en el cerebro después de una transferencia HF, con una escala objetiva diseñada y ligeramente modificada a la original (PGS) para medir estos cambios. Nuestro principal hallazgo fue que, aplicando la escala PGS, para medir la plasticidad después de una transferencia nerviosa en nuestros 70 pacientes, el grado medio de independencia del nervio facial fue pobre (PGS de 1.64), y nunca alcanzó un grado completo de independencia en los casos analizados (PGS 4); entendiendo este último como la contracción de los músculos faciales (músculo objetivo), solo en respuesta a la orden del comando receptor y no del donante (por ejemplo, el ojo se cierra en respuesta a una orden para realizar esa acción, y no cuando se le ordena empujar la lengua contra el paladar duro). Esto implica, a nuestro entender, que a pesar de haber pasado un tiempo prudencial entre la realización de la cirugía y la evaluación de la plasticidad neuronal (más de 12 meses en cada caso), la vía receptora nunca alcanzó su independencia completa, lo que expresa un signo de plasticidad deficiente.
Curiosamente, al comparar la falta de plasticidad cerebral después de una transferencia nerviosa para los músculos faciales con las puntuaciones PGS informadas en transferencias nerviosas para parálisis del plexo braquial en adultos, los resultados son mucho mejores para esta última.18 Cuando se utilizó el nervio frénico como donante para la recuperación de la flexión del codo, el PGS medio logrado fue 2.57; y con empleo del nervio espinal accesorio dirigido al mismo objetivo, un PGS medio de 2.95. Ambas transferencias nerviosas mencionadas son extraplexuales (el nervio donante se extrajo desde fuera del plexo), pero en comparación con las transferencias intraplexuales (el nervio donante se derivó desde dentro del plexo) en la restauración del plexo braquial, estas siempre obtuvieron una puntuación media de PGS aún mejor. Una transferencia del nervio mediano y/o cubital para la flexión del codo alcanzó una media de 3.27, mientras que una rama del tríceps dirigida al nervio axilar mostró una puntuación PGS media de 3.15.
Comparando los resultados entre la plasticidad alcanzada entre las transferencias nerviosas en los pacientes con lesión del plexo braquial y aquellos con parálisis facial, podemos teorizar que las razones que podrían explicar estos hallazgos podrían ser las mayores representaciones volumétricas que tienen la cara y la lengua en las áreas motora primaria y motora suplementaria en comparación con el miembro superior proximal. De manera que para obtener una puntuación de PGS mayor, las cortezas motoras encargadas de los movimientos deben reorganizarse ampliamente, un hecho que a la luz de las limitaciones de la plasticidad cerebral encontradas en los informes previamente mencionados, es imposible de obtener.
No es sorprendente que en bebés pequeños que se sometieron a una transferencia nerviosa por una parálisis del plexo braquial neonatal (PPNB) se observaron resultados aún mejores en PGS en comparación con los reportados para adultos, incluso un resultado uniforme de PGS 4 (plasticidad máxima) después de 22 y 35 transferencias nerviosas en dos series diferentes.24 Sin embargo, si bien en este estudio la edad también fue un factor para obtener una mejor plasticidad final, ninguno de ellos alcanzó un PGS 4. Creemos que quizás la cantidad de pacientes pediátricos fue suficiente para evidenciar algún resultado de máxima plasticidad (PGS 4).
Al igual que en la bibliografía revisada,19,25-30 en nuestro estudio pudimos observar una relación positiva, estadísticamente significativa, entre la frecuencia y/o calidad de la rehabilitación motora (RQS) y la plasticidad cerebral, esto es fundamental para restaurar y potenciar los resultados motores y de plasticidad cerebral. Esta relación, como se pudo observar en el análisis de correlación parcial, es independiente de la edad.
Nuestro estudio tiene fortalezas y debilidades. Una fortaleza importante es que el nivel de desconexión y control voluntario independiente se estudió por primera vez, hasta donde sabemos, en una serie relativamente grande de pacientes que se sometieron a una transferencia nerviosa HF para la reanimación facial. Su debilidad es que, teniendo en cuenta que la edad constituye un factor importante en el desarrollo de PGS 4 en pacientes con lesión del plexo braquial que fueron sometidos a una transferencia nerviosa, el número de pacientes jóvenes en nuestro estudio podría no haber sido lo suficientemente grande como para detectar una puntuación de PGS 4. Se necesitan más estudios para confirmar o rechazar esta suposición. También sería importante evaluar la plasticidad central obtenida a partir de otros nervios donantes como parte de la reparación de la parálisis facial.
CONCLUSIONES
En pacientes con parálisis facial, la anastomosis hipogloso-facial ha sido utilizada a lo largo de los años para reparar la función de los músculos faciales.Este trabajo es el primero en analizar la plasticidad cerebral posterior a dicho procedimiento. En la serie de casos presentada se observó que, si bien la edad tiene una relación negativa y la calidad y/o frecuencia de la rehabilitación kinésica una relación positiva con la plasticidad cerebral, ninguno de los pacientes alcanzó la plasticidad cerebral suficiente para lograr un control voluntario independiente.
Este es un artículo de acceso abierto bajo la licencia CC BY-NC https://creativecommons.org/licenses/by-nc/4.0/
BIBLIOGRAFÍA