Desarrollo de técnicas microquirúrgicas usando tinción vascular con y sin silicona en placenta humana con modelos craneales 3D
Juan Carlos Gómez-Vega1, Juliana Mancera Pérez2, Mateus Reghin Neto3, Vanessa Holanda3, Evandro de Oliveira4
1 Residente de neurocirugía, Pontificia Universidad Javeriana, Unidad de Neurocirugía, Hospital Universitario San Ignacio, Semillero de Neurología y Neurocirugía, Bogotá, Colombia
2 Medica, Pontificia Universidad Javeriana, Bogotá, Colombia
3 Neurocirujano, Institute of Neurological Sciences (ICNE), São Paulo, Brazil. Laboratorio de microcirugia Dr. Evandro de Oliveira, Beneficência Portuguesa Hospital, São Paulo. Adjunct Associate Professor at the Department of Neurosurgery. Mayo Clinic, Jacksonville, Florida, United States.
4 Director, Institute of Neurological Sciences (ICNE), São Paulo, Brazil. Laboratorio de microcirugia Dr. Evandro de Oliveira, Beneficência Portuguesa Hospital, São Paulo. Adjunct Associate Professor at the Department of Neurosurgery. Mayo Clinic, Jacksonville, Florida, United States.
Juan Carlos Gómez Vega
Correo: juancarlosgomezvega18@gmail.com
Recibido: mayo de 2020
Aceptado: julio de 2020
RESUMEN
En las ultimas décadas, ha habido un cambio en la formación en las especialidades quirúrgicas, lo cual ha llevado a plantearse la necesidad de adquisición de habilidades por fuera del quirófano por medio de la simulación. El objetivo de este trabajo es demostrar que el uso de placentas humanas con modelo craneal tridimensional (3D), es un método de alta fidelidad y retroalimentación para el desarrollo de técnicas microquirúrgicas. Se realizó un estudio de evaluación técnica en el Laboratorio de Microcirugía Dr. Evandro de Oliveira del Hospital de la Beneficiencia de Portugal de São Paulo, utilizando 15 placentas con técnicas de coloración y preservación vascular con silicona para moldes; realizando ejercicio de anastomosis vasculares, ejercicios de disección parenquimatosa placentaria que remedan la disección aracnoidea y del valle silviano, además de simulación de resección de tumores. Cualitativamente la placenta humana es un método con alta fidelidad y retroalimentación, además, es de acceso universal para la adquisición de habilidades microquirúrgicas, que asociada a un modelo craneal 3D permite el perfeccionamiento de craneotomías, coordinación visomotriz, propiocepción y relación de profundidad que se requieren para abordajes neuroquirúrgicos.
Palabras Claves: Microcirugía; Revascularización Cerebral; Placenta; Simulación
ABSTRACT
In the last decades, there has been a change in training in surgical specialties, which has led to the need to acquire skills outside the operating room through simulation. The aim of this work is to demonstrate that the use of human placentas with a three-dimensional (3D) cranial model is a high fidelity and feedback method for the development of microsurgical techniques. A technical evaluation study was carried out in the Dr. Evandro de Oliveira Microsurgery Laboratory of the Hospital de la Beneficiencia de Portugal in São Paulo, using 15 placentas with coloration techniques and vascular preservation with silicone for molds; performing vascular anastomosis, placental parenchymal dissection exercises that mimic arachnoid and sylvian fissure dissection, in addition to simulating tumor resection. Qualitatively, the human placenta is a method with high fidelity and feedback, and it is also universally accessible for the acquisition of microsurgical skills, which, associated with a 3D cranial model, allows the refinement of the craniotomies, visomotor coordination, proprioception, and depth relationship required for neurosurgical approaches.
Key words: Microsurgery; Cerebral Revascularization; Placenta; Simulation
INTRODUCCIÓN
Durante las últimas décadas en las residencias médico-quirúrgicas han surgido múltiples cambios, esto debido a un aumento en las restricciones de los residentes sobre las horas de trabajo, aumento de pacientes con condiciones criticas y cirugías técnicamente exigentes, además de las preocupaciones sobre la responsabilidad médica, lo que ha llevado a una reducción en el acceso directo de los residentes a las salas de cirugía, especialmente durante los primeros años, condicionando a una exposición mínima de ciertos tipos de cirugías.1,2 Es por esto, que la capacitación de la próxima generación de cirujanos en procedimientos complejos es un desafío, especialmente en cirugías neurovasculares cuyos procedimientos tienen indicaciones limitadas y específicas, conllevando a que el volumen general de estas intervenciones y el número de centros especializados que realizan estos procedimientos de manera rutinaria están disminuyendo. Adicionalmente, solo unos pocos neurocirujanos han adquirido las habilidades específicas para realizar adecuadamente dichos procedimientos, lo que posiblemente se traduciría en un aumento en las tasas de complicaciones postoperatorias secundario a la realización de procedimientos por egresados que no han adquirido completamente dichas habilidades.1-4
Es por lo anterior, que surge la necesidad del uso de simuladores como herramienta para la adquisición de dichas técnicas quirúrgicas por fuera del quirófano. Es importante destacar que estos simuladores tienen un desarrollo táctil inherente, retroalimentación u otras cualidades físicas suficientes para calificarlos como herramientas de entrenamiento apropiadas o confiables para las técnicas requeridas en cirugía real, especialmente neurocirugía cerebrovascular, dado que la capacidad del neurocirujano vascular podría mantenerse de manera segura trabajando con un simulador de alta fidelidad.5-8
En la actualidad, no existe evidencia en la literatura hasta el momento que haya analizado si la utilización de modelos placentarios o de arterias sintéticas ayuden a mejorar la habilidad quirúrgica del neurocirujano.7,9-11 Por esto, el objetivo de este trabajo es demostrar que el uso de modelos placentarios con técnicas de preservación vascular y arterias sintéticas mejora las habilidades neuroquirúrgicas básicas necesarias para la adquisición de habilidades avanzadas en la practica real, además del uso de modelos craneales en 3D que simulan procedimientos de neurocirugía vascular y tumoral.
MATERIALES Y MÉTODOS
Se realizó un estudio de evaluación técnica, el cual se desarrolló en el Laboratorio de Microcirugía Dr. Evandro de Oliveira del Hospital de la Beneficencia de Portugal de São Paulo, aprobado por el comité de ética local. La placenta después del parto se colocó en un refrigerador para su uso en el proyecto. Se utilizaron 15 placentas para los diferentes tipos de coloración vascular con y sin silicona, además de simulación quirúrgica y de anastomosis.10,12-15 Para la selección de los ejercicios de simulación de técnicas vasculares, se usaron las vasculatura placentaria mas distal al cordón umbilical, ya que son las que en estudios se ha demostrado con mayor similitud a las arterias cerebrales en cuanto su diámetro; las cuales, según el estudio de Magaldi et al. estaban ubicadas en la zona mas distal de la vasculatura placentaria, la cual denominaron, zona 4.16
Los materiales microquirúrgicos utilizados para todas las actividades fueron: colorante a base de agua rojo y azul (marca Coral 50 ml, São Paulo, Brasil), silicona para molde más catalizador (marca SIQMOL de siquiplás 1kg y catalizador de 40g de la misma marca, São Paulo, Brasil), placenta humana previamente preparada; tijeras de microcirugía; pinzas de microcirugía (pinzas de relojero); porta agujas de microcirugía; seda 4-0 para oclusión vascular; sutura 9-0 monofilamento no absorbible; jeringa y aguja de insulina; Solución salina al 0,9%.
Técnica de coloración vascular placentaria con y sin silicona
A todas las placentas se les inyectó solución salina normal en la vena placentaria y 2 arterias durante aproximadamente 15 a 20 minutos para eliminar toda la sangre y los coágulos de los vasos. La membrana corioamniotica se retiró de la superficie para permitir una mejor visualización de los vasos. Aquellas placentas que fueron usadas para realización de anastomosis cerebrales, se les canalizó la vena y las arterias con una sonda nélaton número 6, posteriormente se realizó un nudo con seda 1-0 en el extremo proximal del cordón umbilical, luego se realizó una mezcla de tinción vascular para cada una. Las placentas usadas para realización de disección aracnoidea, fisura silviana y simulación de resección tumoral, no se les retiro la membrana corioamniotica, en aquellas utilizadas para la realización de anastomosis cerebral, si se les retiro. A todas se les canalizo la vena y las dos arterias con una sonda nélaton numero 6, seguido de un nudo con seda 1-0 en el extremo proximal del cordón umbilical para evitar la extravasación del material. A algunas placentas se les realizó coloración vascular con colorante a base de agua color rojo (arterial) y azul (venoso); a otras placentas se realizo técnica de coloración con una mezcla de silicona liquida para moldes mas catalizador mezclada con color rojo (arterial) y azul (vena). Posteriormente, las placentas se alojaron en el refrigerador entre 6-12 horas previo a su uso13,17 (figura 1).
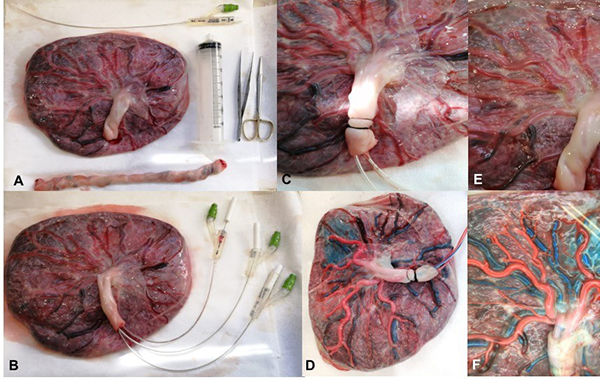
Figura 1: Técnica de preparación de la placenta humana. A. Se deja aproximadamente una longitud de 10-15 cm de cordón umbilical, el resto se corta con unas tijeras, se debe contar con pinza con garra, jeringa de 50 cc y 3 sondas nélaton numero 6. B. Se canalizan las 2 arterias y la vena con sonda nélaton. C. Se realiza nudo con seda cerca de la porción final del cordón umbilical. D. Se realiza la coloración con colorante a base de agua y con una mezcla de silicona liquida más catalizador. E y F. Se busca comparar una placenta sin preparación y otra con preparación.
Simulación de abordaje quirúrgico y resección tumoral con modelos craneales 3D
A estas placentas no se les retiro la membrana corioamniótica, se realizó la técnica de coloración vascular con silicona previamente descrita, se inyecto silicona liquida mas catalizador de color blanco y/o negro en el estroma placentario adyacentes a relaciones vasculares para simular lesiones tumorales, finalmente, la placenta fue posicionada dentro de un molde craneal tridimensional (3D). El ejercicio simula un abordaje craneal incluyendo craneotomía, seguido de disección aracnoidea y del valle silviano, y termina con técnica microquirúrgica de resección de un tumor intra y/o extraaxial dependiendo de la ubicación de la silicona (figura 2).
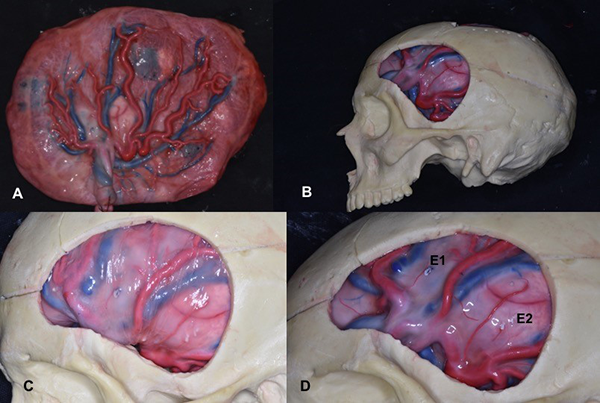
Figura 2: Preparación de placenta humana con modelos craneales 3D. A. Placenta previamente preparada con silicona, se realiza inyección en el estroma placentario de silicona color negro y blanco, para simular un tumor. B. Se posiciona la placenta en un modelo de cráneo en 3D, se puede realizar cualquier tipo de abordaje, en este caso se ilustrar un abordaje frontotemporal izquierdo. C. Se ilustra la practica de disección aracnoidea y del valle silviano retirando cuidadosamente la membrana corioamniótica. D. Después de retirar la aracnoides, se pretende simular la resección de un tumor ubicado en el lóbulo frontal (E1) o temporal (E2) bajo técnica microquirúrgica.
RESULTADOS
Anastomosis vascular
- La placenta se sometió a limpieza higiénica y se colocó en la mesa de procedimientos.
- Las arterias se examinaron cuidadosamente bajo el microscopio para poder elegir los mejores vasos.
- Se retiro la membrana corioamniótica con las pinzas.
- El segmento vascular se disecó y se liberó del estroma placentario bajo técnica microquirúrgica con pinzas de relojero, microtijeras y bisturí.
- Se colocó una pieza de guante blanco en forma rectangular o triangular entre el vaso y el estroma placentario para facilitar la visualización bajo el microscopio del procedimiento.
- Se aplicaron dos sedas para aislar su contenido a una distancia cada una de aproximadamente 1.5-2 cm.
- Se realizó adventicectomía de 6 mm con pinzas y microtijeras.
- Se realizó una incisión lineal longitudinal superficial con bisturí en el segmento aislado del vaso.
- El vaso se limpió con solución salina fisiológica para remover su contenido, en caso de usarse la técnica de coloración vascular con silicona, el molde formado por la silicona, fue retirado con pinzas. Se identificaron las paredes de los vasos.
- La pared vascular se suturó con un hilo de sutura 9-0 en puntos separados, con apoyo de pinzas de relojero y porta aguas de microcirugía.
- Se mantuvo el principio de sutura vascular.
- El punto se pasó a una distancia que corresponde al doble del grosor del vaso que se sutura.
- La distancia entre cada punto corresponde a la equivalencia de cuatro veces el grosor de la pared del vaso que se sutura.
- Una de estas paredes vasculares se sostuvo con microforceps para realizar la sutura.
- La pared contralateral fue sostenida por su membrana adventicia, finalizando el paso de la aguja y el punto en la pared vascular.
- Todo el trabajo debe hacerse bajo el microscopio. Cada sutura debe estar anudada de tres a cuatro veces. Las sedas deben retirarse después del final de cada síntesis vascular y la permeabilidad vascular debe analizarse con la coloración cruzada a lo largo de la arteria. En casos de usar la técnica de coloración vascular con silicona, no se puede verificar permeabilidad de la anastomosis.
Termino-Terminal
- Se repitieron los pasos 1 a 7.
- Se realizó un corte perpendicular en la pared arterial con un bisturí y microtijeras.
- La anastomosis termino-terminal vascular se inició con dos microforceps y una sutura 9-0.
- La primera sutura se realizó en el borde superior del vaso. Se mantuvo el principio de sutura vascular descrito previamente.
- La segunda sutura se realizó en el borde inferior del vaso.
- Se giró el vaso con los microforceps para exponer el segmento posterior de la anastomosis.
- Se realizo la sutura con puntos separados en la pared posterior, la cual es la parte mas difícil de la anastomosis, se debe apoyar la suturada con tracción de la adventicia para no desgarrar la pared vascular.
- Se dio la vuelta al vaso para trabajarlo en el segmento anterior de la anastomosis.
- Se realizo la sutura continuando los puntos simples separados en la parte anterior del vaso.
- Se verifico la permeabilidad vascular de la anastomosis retirando las sedas para aquellos vasos con coloración vascular. En casos de usar la técnica de coloración vascular con silicona, no se puede verificar permeabilidad de la anastomosis (figura 3).
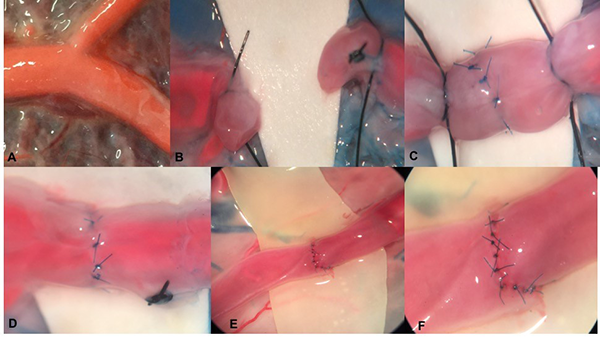
Figura 3: Anastomosis termino-terminal. A. Placenta previamente preparada con tinción vascular, se fijan sedas temporales a una distancia de 1.5-2 cm cada una. B. Se realiza corte perpendicular, se realiza limpieza intravascular con suero fisiológico y adventicectomía. C. Se realiza la anastomosis terminoterminal con sutura 9-0. D. Se retiran las sedas, se verifica permeabilidad de la anastomosis, no se evidencian fugas en la misma. E y F. Anastomosis terminoterminal en un vaso tratado con técnica de coloración vascular con silicona.
Termino-Lateral
- Se repitieron los pasos 1 a 7.
- La arteria que servirá como donante se preparó de acuerdo con las técnicas de sutura vascular de los pasos 1 a 7 descritas anteriormente.
- Se realizó una arteriotomía forma de boca de pez en la arteria donante (oblicuo en la parte distal que se continua con un corte longitudinal). Una arteria donante en boca de pez da la forma a un pie, con el dedo del pie en la punta distal al final del corte oblicuo y el talón en el extremo proximal del corte longitudinal.
- En el vaso receptor, se realizó una arteriotomía elíptica que puede ser en la porción anterior o lateral.
- La sutura del talón se coloca primero en la arteria donante con forma boca de pez, tomando el primer paso de la aguja en el talón se realiza de afuera hacia adentro de la arteria del donante y volteando el pie del donante para visualizar la luz de la arteria donante. El Segundo punto se realiza de adentro hacia afuera en la arteria receptora. Completa el primer punto Se mantuvo el principio de sutura vascular que se describió previamente.
- El segundo punto se realiza en la punta del pie, empezando en la arteria donante, aguja de afuera hacia adentro y luego en la arteria receptora de adentro hacia fuera, se anuda y completa el segundo punto.
- En primera instancia, la sutura se realizó en el segmento anatómico posterior en puntos separados. Se considera que este segmento es más difícil.
- Este procedimiento se repitió en el lado anterior.
- Se verificó la permeabilidad vascular de la anastomosis retirando las sedas para aquellos vasos con coloración vascular. En casos de usar la técnica de coloración vascular con silicona, no se puede verificar permeabilidad de la anastomosis (figura 4).

Figura 4: Anastomosis terminolateral. A. Placenta previamente preparada con tinción vascular, con intención se realiza apertura distal de la arteria, evidenciándose extravasación de la coloración vascular, lo cual nos demuestra la importancia de la tinción vascular para la retroalimentación en los ejercicios de disección y anastomosis vascular. B. Se realiza adventicectomía y abertura distal de la arteria en forma de boca de pescado de la arteria donante. C. En la arteria receptora, se fijan sedas temporales a una distancia de 1.5-2 cm cada una, se observa la apertura en forma de pescado en la arteria donante, es necesario determinar el diámetro de la arteria donante para poder realizar la arteriotomía en la arteria receptora. D. Se realiza una arteriotomía elíptica y lavado profuso con solución salina intravascular. E. Se realiza anastomosis terminolateral con sutura 10-0. F y G. Se retiran las sedas, se verifica permeabilidad de la anastomosis, no se evidencian fugas en la misma. H. Anastomosis terminolateral en un vaso tratado con técnica de coloración vascular con silicona.
Latero-Lateral
- Se repitieron los pasos 1 a 7.
- Se realizo una arteriotomía longitudinal en los dos vasos (donante y receptor)
- Se realizo punto en el vértice inferior, y se siguió con una sutura continua simple de la parte posterior de los vasos hasta el vértice superior.
- Se realizo seguidamente una sutura continua simple en la parte anterior de los vasos y se unió al cabo de sutura del vértice inferior.
- Se verifico la permeabilidad vascular de la anastomosis retirando las sedas para aquellos vasos con coloración vascular. En casos de usar la técnica de coloración vascular con silicona, no se puede verificar permeabilidad de la anastomosis (figura 5).
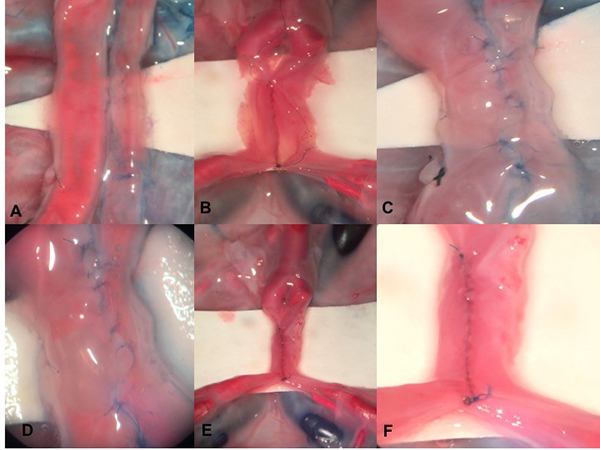
Figura 5: Anastomosis laterolateral. A. Placenta previamente preparada con tinción vascular, se fijan sedas temporales a una distancia de 1.5-2 cm cada una, se realiza arteriotomía longitudinal en ambas arterias. B. La anastomosis se inicia en el extremo inferior y en la pared posterior de las arterias con sutura continua simple 9-0. C. Se continua con el extremo superior y la pared anterior de los vasos. D. Se retiran las sedas, se verifica permeabilidad de la anastomosis, no se evidencian fugas en la misma. E y F. Anastomosis laterolateral en un vaso tratado con técnica de coloración vascular con silicona.
Ejercicio de simulación de disección aracnoidea, valle silviano y resección tumoral con modelos craneales en 3D
La técnica de ejercicios que remedan la disección aracnoidea, fisura silviana, disección vascular y resección tumoral se realizaron en placentas cuya tinción vascular fue hecha con silicona, y estas fueron introducidas en modelos craneales 3D. Con disección microquirúrgica se retiro cuidadosamente la membrana corioamniótica, la cual simula la membrana aracnoidea, posteriormente, se realizo disección entre cotiledones y parénquima de la placenta, simulando el valle silviano, y finalmente, en las zonas donde se encontraba el “tumor” se realizó resección del mismo con preservación de la vasculatura perilesional. El mismo procedimiento fue realizado en las placentas introducidas en modelos craneales 3D, para la cual, se debía realizar una craneotomía para simular lo mas cercano posible a la realidad, se realizó la resección de una lesión tumoral parenquimatosa (figura 6).

Figura 6: Simulación de resección microquirúrgica de tumor con modelo craneal en 3D. A. Placenta previamente preparada con silicona, se realiza inyección en el estroma placentario de silicona color negro y blanco, para simular un tumor extraaxial. B. Evidencia del tumor de color negro. C. Se aprecia como se simula el tumor (silicona en color negro) con irrigación (arterias tinción vascular con silicona), lo cual hace mas real la devascularización tumoral. D y E. Se realiza resección del tumor respetando el plano entre la misma y parénquima cerebral (estroma placentario). F. Se verifica el lecho tumoral, no evidencia de tumor, podemos hacer hemostasia.
Evaluación y valoración de la técnica
Consideramos a la placenta humana asociada con modelos craneales 3D como un modelo ideal en el entrenamiento afuera de salas de cirugía para la adquisición de habilidades básicas y avanzadas de la microcirugía. Dentro de las ventajas se encuentran: Acceso universal, no requiere de preparación especial y se conservan bajo refrigeración, las arterias tienen diferente calibre y las mas distales poseen un diámetro similar al de las arterias cerebrales, se puede hacer retroalimentación de la sutura de anastomosis vascular cuando se realiza técnica de tinción con colorante a base de agua una vez se retiran las cedas proximal y distal a la anastomosis, se puede realizar practicar la realización de una craneotomía al unirse con modelo craneal 3D, afianzando el fresado, manejo y control de las revoluciones del motor además del reconocimiento e identificación de puntos craneométricos para la misma; la membrana corioamniótica permite remeda la membrana aracnoidea y la inyección de silicona en el estroma placentario permite realizar disección microquirúrgica por medio del reconocimiento del plano “tumor y estroma placentario”, permite simular la devascularización tumoral la cual es uno de los pilares en técnicas quirúrgica de resección de meningiomas, fortalece el reconocimiento y manipulación del microscopio y instrumental quirúrgico, sumado a que mejora la coordinación visomotriz al manejar diferentes tipos planos de profundidad. Como desventajas, consideramos una limitante para la adquisición y aval del comité de ética para manejo de placentas en ciertos lugares donde el laboratorio de microcirugía no se asocia a un servicio de ginecoobstetricia, la placenta es un material biológico no vivo que no cuenta con la hidrodinámica del liquido cefalorraquídeo, los modelos craneales 3D no permite realización de incisión y disección por planos incluyendo los planos musculares, importantes en la elaboración del corredor externo del abordaje quirúrgico, la silicona permite una mejor definición de la vasculatura placentaria y definición de estas en el estroma placentario, sin embargo, no permite la retroalimentación de fugas en la anastomosis o errores en la disección microquirúrgica, como lesionar una arteria y/o vena, que si es permitida por la técnica de tinción vascular con colorante.
DISCUSIÓN
La evidencia ha demostrado déficits en la atención y la coordinación mano-ojo después de la privación del sueño, lo cual sugiere que la fatiga del médico puede comprometer la seguridad del paciente, particularmente para la población quirúrgica, por esto, los objetivos establecidos de las limitaciones de horas de trabajo fueron mejorar la seguridad del paciente, el bienestar de los residentes y la educación.1 Esto ha implicado que el entrenamiento medicoquirúrgico haya sufrido cambios radicales en los últimos años; argumentándose que pasar menos tiempo en el hospital en última instancia puede conducir a la formación de cirujanos menos experimentados y menos competentes, lo cual significaría en un efecto dramático en la competencia operativa, resultados educativos y desenlaces negativos en los pacientes.1,2 Se considera que para ser "Experto" en el campo de la neurocirugía se requiere un tiempo de preparación necesario de 10.000 horas o aproximadamente 10 años,18 y en el ámbito de la neurocirugía vascular, al menos 60 casos al año,4 por esto, surge el interrogante, ¿Cuándo los cirujanos jóvenes llegan a ser expertos en esta área?
En respuesta a lo planteado previamente, la simulación se ha utilizado en muchos campos no médicos para la adquisición de habilidades técnicas antes del rendimiento en la vida real y en los últimos años se ha identificado como una herramienta útil en el entrenamiento quirúrgico, por ser un método eficaz y comprobado para enseñar y/o evaluar a los alumnos en los programas de residencia en cirugía.6,14,19 Los residentes requieren de experiencia práctica indirecta para familiarizarse con los instrumentos quirúrgicos, coordinación mano-ojo bajo la “vista” microscópica, manipulación de tejido cerebral y/o vascular, además de la realización de la microanastomosis; ayudando al desarrollo de habilidades microquirúrgicas manuales importantes y retroalimentación, con el fin de evitar errores técnicos que aumentan la morbilidad y mortalidad del paciente.5,6,8 Hoy por hoy, la cultura de 'ver uno, hacer uno, enseñar uno' se está reemplazando rápidamente por 'hacer muchos en un simulador, lograr competencias y luego actuar bajo supervisión en la sala de operaciones'.8
La habilidad fundamental en un procedimiento de bypass cerebrovascular es realizar una anastomosis microvascular, que se puede aprender a través de una variedad de métodos, divididos entre modelos no vivos y vivos.7,9,11,14,19,20 Los modelos no vivos más comunes incluyen vasos artificiales, modelos animales simulados, tejido de cadáveres y placentas, mientras que los modelos vivos incluyen animales anestesiados (roedores, cerdos, bovinos, entre otros). Todos estos modelos tienen sus ventajas y desventajas, por ejemplo, los modelos animales son costosos y requieren un entorno de laboratorio relativamente complejo que no está disponible universalmente, la exposición del vaso no siempre es fácil, y en caso de daño vascular inadvertido puede provocar hemorragia masiva y la muerte prematura del animal, sumado a esto, las cuestiones éticas sobre el uso de animales con fines prácticos son otra limitación importante de los modelos de alta fidelidad.7,10,11,16,19,21
La placenta humana es un material excelente para el entrenamiento de la técnica microquirúrgica, la superficie fetal tiene una membrana corioamniotica muy similar a la aracnoides cerebral y un rico componente vascular con vasos de 1–6 mm de diámetro, la cual la hace muy similar al diámetro de las arterias cerebrales (arteria cerebral anterior tiene un diámetro de 1–3 mm y la arteria cerebral media tiene entre 2,4 y 4,6 mm, la arteria vertebral tiene un diámetro de 0,92–4,09 mm, las arterias cerebrales posteriores y cerebrales posteriores inferiores tienen entre 0,65 y 1,78 mm). Por lo tanto, la placenta humana es un material excelente para el entrenamiento en técnicas microquirúrgicas.10,13,16,20
Basados en la experiencia y evaluación técnica del presente trabajo, consideramos que la adquisición de habilidades microquirúrgicas en simulación en placentas humanas y modelos craneales 3D es una herramienta de bajo costo, de acceso universal, de fácil preparación y que no requiere de insumos especiales para la misma, así mismo, permite una familiarización del instrumental quirúrgico, posee una alta fidelidad por la retroalimentación positiva en diferentes tópicos que uno la trabaje, simulando disección meníngea, disección arterial y venosa con verificación de lesión vascular y de la anastomosis, además adquisición de habilidades en la disección microquirúrgica simulando patología tumoral. Así mismo, la simulación placentaria con modelos craneales en 3D, que no ha sido publicada previamente, une las ventajas para la adquisición de habilidades que nos da el trabajo con placentas humanas, y suma la posibilidad de tener un contacto que remeda el escenario quirúrgico al tener que enfrentarnos a la realización de una craneotomía de acuerdo a la ubicación de la lesión que estemos simulando, condicionando a la mejora de coordinación viso-motriz, la propiocepción y percepción de profundidad en el momento de trabajar en un espacio reducido por la craneotomía que realicemos, lo cual es, a lo que nos enfrentamos día a día en procedimientos neuroquirúrgicos. Una desventaja de estos últimos, es el costo adicional que implica mandar a realizar el modelo 3D, sin embargo, es una alternativa en donde hay un acceso limitado para el empleo de cadáveres humanos. Consideramos como limitación de nuestro trabajo, el valor cualitativo del mismo y que la presente técnica no es comparada con otras técnicas, por esto, se pretende en un futuro realizar un estudio que comprare nuestra propuesta contra otros métodos de adquisición de habilidades microquirúrgicas.
Los procedimientos neuroquirúrgicos se reducen a agujeros de trepanación, colocación de marcos, biopsias con aguja y manipulación de catéteres. No obstante, se necesitan neurocirujanos cerebrovasculares abiertos aún más competentes y armados con habilidades microquirúrgicas para abordar las lesiones más complejas y desafiantes, ya que, la destreza sigue siendo la magia que hace que la microcirugía ocurra.3,5 De manera que, es necesaria una práctica y experiencia adecuada para lograr buenos resultados después de una cirugía de revascularización cerebral, resección de una malformación vascular u otro procedimiento neurovascular abierto, requiriéndose una práctica regular para mantener o mejorar la destreza manual y habilidades quirúrgicas, complementándose con horas de practica en simulación y disección dentro del laboratorio de microcirugía.
CONCLUSIÓN
Hoy en día nos enfrentamos a cambios que restringen el numero de horas de trabajo en el hospital, y como consecuencia, una menor exposición al quirófano. En respuesta a esto, la simulación se convierte en una herramienta de entrenamiento para el desarrollo de habilidades quirúrgicas, con retroalimentación u otras cualidades físicas apropiadas y confiables para las técnicas requeridas en cirugía real. Consideramos que la placenta humana con modelo craneal tridimensional es uno de los mejores métodos por su alta fidelidad y acceso universal. Este trabajo, se convierte en el primer estudio en implementar la placenta humana con modelos craneales tridimensionales para la adquisición de habilidades microquirúrgicas en neurocirugía vascular y oncológica.
BIBLIOGRAFÍA
- Aboud E, Al-Mefty O, Yaşargil MG. New laboratory model for neurosurgical training that simulates live surgery. J Neurosurg. 2002;97(6):1367–72.
- Ahmed N, Devitt KS, Keshet I, Spicer J, Imrie K, Feldman L, et al. A systematic review of the effects of resident duty hour restrictions in surgery: Impact on resident wellness, training, and patient outcomes. Ann Surg. 2014;259(6):1041–53.
- Lawton MT, Lang MJ. The future of open vascular neurosurgery: perspectives on cavernous malformations, AVMs, and bypasses for complex aneurysms. J Neurosurg [Internet]. 2019 May;130(5):1409–25. Available from: https://thejns.org/view/journals/j-neurosurg/130/5/article-p1409.xml
- Tayebi Meybodi A, Lawton MT, Yousef S, Mokhtari P, Gandhi S, Benet A. Microsurgical Bypass Training Rat Model: Part 2–Anastomosis Configurations. World Neurosurg [Internet]. 2017;107:935–43. Available from: https://doi.org/10.1016/j.wneu.2017.06.066
- Aboud E, Al-Mefty O, Yaşargil MG. New laboratory model for neurosurgical training that simulates live surgery. J Neurosurg. 2002;97(6):1367–72.
- Dietl CA, Russell JC. Effects of Technological Advances in Surgical Education on Quantitative Outcomes from Residency Programs. J Surg Educ [Internet]. 2016;73(5):819–30. Available from: http://dx.doi.org/10.1016/j.jsurg.2016.03.016
- Hwang G, Oh CW, Park SQ, Sheen SH, Bang JS, Kang HS. Comparison of different microanastomosis training models: Model accuracy and practicality. J Korean Neurosurg Soc. 2010;47(4):287–90.
- Tsuda S, Scott D, Doyle J, Jones DB. Surgical Skills Training and Simulation. Curr Probl Surg [Internet]. 2009 Apr;46(4):271–370. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0011384008001792
- Chueh JY, Wakhloo AK, Gounis MJ. Neurovascular modeling: Small-batch manufacturing of silicone vascular replicas. Am J Neuroradiol. 2009;30(6):1159–64.
- Magaldi MO, Nicolato A, Godinho J V., Santos M, Prosdocimi A, Malheiros JA, et al. Human placenta aneurysm model for training neurosurgeons in vascular microsurgery. Clin Neurosurg. 2014;10(4):592–601.
- Steinberg JA, Rennert RC, Levy M, Khalessi AA. A Practical Cadaveric Model for Intracranial Bypass Training. World Neurosurg. 2019;121:e576–83.
- Ramanathan D, Hegazy A, Mukherjee SK, Sekhar LN. Intracranial in situ side-to-side microvascular anastomosis: Principles, operative technique, and applications. World Neurosurg [Internet]. 2010;73(4):317–25. Available from: http://dx.doi.org/10.1016/j.wneu.2010.01.025
- Romero FR, Fernandes ST, Chaddad-Neto F, Ramos JG, De Campos JM, De Oliveira E. Microsurgical techniques using human placenta. Arq Neuropsiquiatr. 2008;66(4):876–8.
- Tayebi Meybodi A, Lawton MT, Yousef S, Mokhtari P, Gandhi S, Benet A. Microsurgical Bypass Training Rat Model: Part 2–Anastomosis Configurations. World Neurosurg [Internet]. 2017;107:935–43. Available from: https://doi.org/10.1016/j.wneu.2017.06.066
- Thanapal S, Duvuru S, Sae-Ngow T, Kato Y, Takizawa K. Direct cerebral revascularization: Extracranial-intracranial bypass. Asian J Neurosurg [Internet]. 2018;13(1):9. Available from: http://www.asianjns.org/text.asp?2018/13/1/9/224841Ramanathan D, Hegazy A, Mukherjee SK, Sekhar LN. Intracranial in situ side-to-side microvascular anastomosis: Principles, operative technique, and applications. World Neurosurg [Internet]. 2010;73(4):317–25. Available from: http://dx.doi.org/10.1016/j.wneu.2010.01.025
- Oliveira MM, Wendling L, Malheiros JA, Nicolato A, Prosdocimi A, Guerra L, et al. Human Placenta Simulator for Intracranial–Intracranial Bypass: Vascular Anatomy and 5 Bypass Techniques. World Neurosurg [Internet]. 2018;119:e694–702. Available from: https://doi.org/10.1016/j.wneu.2018.07.246
- Srinivasan J, Ellenbogen RG, Britz GW, Newell DW. Techniques for cerebral bypass: practical laboratory for microvascular anastomosis. Neurosurg Clin N Am [Internet]. 2001 Jul;12(3):509–17, viii. Available from: http://www.ncbi.nlm.nih.gov/pubmed/11390311
- Ericsson KA. Deliberate Practice and the Acquisition and Maintenance of Expert Performance in Medicine and Related Domains. Acad Med [Internet]. 2004 Oct;79(Supplement):S70–81. Available from: http://journals.lww.com/00001888-200410001-00022
- Mokhtari P, Tayebi Meybodi A, Lawton MT, Payman A, Benet A. Transfer of Learning from Practicing Microvascular Anastomosis on Silastic Tubes to Rat Abdominal Aorta. World Neurosurg [Internet]. 2017;108:230–5. Available from: https://doi.org/10.1016/j.wneu.2017.08.132
- Ribeiro De Oliveira MM, Ferrarez CE, Ramos TM, Malheiros JA, Nicolato A, Machado CJ, et al. Learning brain aneurysm microsurgical skills in a human placenta model: Predictive validity. J Neurosurg. 2018;128(3):846–52.
- De Oliveira MMR, Nicolato A, Santos M, Godinho JV, Brito R, Alvarenga A, et al. Face, content, and construct validity of human placenta as a haptic training tool in neurointerventional surgery. J Neurosurg. 2016;124(5):1238–44.
- Thanapal S, Duvuru S, Sae-Ngow T, Kato Y, Takizawa K. Direct cerebral revascularization: Extracranial-intracranial bypass. Asian J Neurosurg [Internet]. 2018;13(1):9.
- Tsuda S, Scott D, Doyle J, Jones DB. Surgical Skills Training and Simulation. Curr Probl Surg [Internet]. 2009 Apr;46(4):271–370. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0011384008001792
- Vespa P, Diringer MN. High-volume centers. Neurocrit Care. 2011;15(2):369–72.
COMENTARIO
En este trabajo se describe la técnica de preparación de placentas como modelo de simulación en laboratorio para la adquisición de habilidades microquirúrgicas de una manera controlada en diversos escenarios hipotéticos (anastomosis vasculares, disección aracnoidea y resección de tumores). Los modelos experimentales empleados de forma clásica en los laboratorios van desde aquellos de origen no animal como los tubos semirrígidos de silicón, plástico, polímeros ó vasos suaves de hidrogel de polivinilo, hasta el uso de guantes de látex para practicas iniciales y familiarización con microinstrumentos y microsuturas.1,2 El siguiente nivel lo representan los modelos que emplean tejido animal, por ejemplo, arterias de pollo o pavo localizadas en las alas o en el pescuezo, arterias aisladas de bovinos o porcinos, placentas bovinas o animales de laboratorio.3-5 En este último caso, para uso de animales vivos se requiere la disponibilidad de un bioterio y el cumplimiento de normas internacionales para el uso de animales en laboratorio. El tercer nivel lo representa el uso de material humano (especímenes cadavéricos o placentas). El uso de material cadavérico preparado es muy útil para la practica y enseñanza de la anatomía, pero debido a los procesos de preparación no son óptimos para la práctica de anastomosis vasculares.6 Por otra parte, el uso de placentas humana es un recurso de bajo costo, asemeja mucho a la red vascular cerebral pero requiere una coordinación con el departamento de obstetricia y en ocasiones la autorización del comité de ética institucional.
Los modelos experimentales deben acercarse lo mas posible a las condiciones encontradas en la práctica quirúrgica. En este sentido, este modelo cumple con este requisito fundamental, ya que emplea de forma complementaria modelos 3D de cráneotomías simuladas con la posibilidad de realizar anastomosis en diferentes vasos (superficiales o profundos) que mimetizan las condiciones técnicas y dificultades encontradas por ejemplo, en anastomosis profundas de la arteria temporal superficial a la arteria cerebral posterior o de la arteria occipital a la cerebelosa póstero-inferior (PICA). El modelo aquí propuesto, es de menor costo que los modelos comerciales existentes que combinan el empleo de cráneos de material plástico, cerebros de silicón y el uso de segmentos arteriales bovinos o porcinos (figura 1).7 En este caso, el modelo permite también simular tumores de origen extra-axial (extrínsecos) para entrenar técnicas de microdisección tan útiles en enfermedades tumorales como meningiomas o metástasis entre otros, por lo que se convierte en un modelo muy apropiado para prácticas microquirúrgicas. Las únicas limitaciones para su uso generalizado es la disponibilidad de placentas en hospitales no relacionados a servicios de obstetricia y el costo de materiales para su preparación (catéteres, silicón, pinturas, etc.) aunque cabe decirlo, en general son de bajo costo y de fácil adquisición.
El ultimo punto que debe considerarse en futuras publicaciones que empleen este modelo es desarrollar un método para probar de forma sistemática y controlada las habilidades adquiridas con su uso.8-11

Figura 1: Modelo de alto costo para entrenamiento experimental de anastomosis vasculares que emplea modelos plásticos de cráneo con craneotomías simuladas y cerebros de silicón con segmentos arteriales bovinos o porcinos.
Edgar Nathal
Departamento de Neurocirugía Vascular. Instituto Nacional de Neurología y Neurocirugía “Manuel Velasco Suarez”. Ciudad de México, México.
BIBLIOGRAFÍA
- Meier S. A., Lang A., Beer G. M. Training von Mikrogefässanastomosen an Polyurethangefässen zur Reduktion von Tierversuchen. ALTEX 21.3/04. 2004;135
- Mutoh T., Ishikawa T., Ono H., Yasui N. A new polyvinyl alcohol hydrogel vascular model (KEZLEX) for microvascular anastomosis training. Surgical Neurology International. 2010;1(74) doi: 10.4103/2152-7806.72626.
- Bates B. J., Wimalawansa S. M., Monson B., Rymer M. C., Shapiro R., Johnson R. M. A simple cost-effective method of microsurgical simulation training: The turkey wing model. Journal of Reconstructive Microsurgery. 2013;29(9):615–618. doi: 10.1055/s-0033-1354740.
- Belykh E., Lei T., Safavi-Abbasi S., et al. Low-flow and high-flow neurosurgical bypass and anastomosis training models using human and bovine placental vessels: A histological analysis and validation study. Journal of Neurosurgery. 2016;125(4):915–928. doi: 10.3171/2015.8.JNS151346.
- Shurey S., Akelina Y., Legagneux J., Malzone G., Jiga L., Ghanem A. M. The rat model in microsurgery education: Classical exercises and new horizons. Archives of Plastic Surgery. 2014;41(3):201–208. doi: 10.5999/aps.2014.41.3.201.
- Olabe J., Olabe J., Sancho V. Human cadaver brain infusion model for neurosurgical training. World Neurosurgery. 2009;72(6):700–702. doi: 10.1016/j.surneu.2009.02.028.
- Ishikawa T., Yasui N., Ono H. Novel brain model for training of deep microvascular anastomosis. Neurologia medico-chirurgica. 2010;50(8):627–629. doi: 10.2176/nmc.50.627.
- Selber J. C., Chang E. I., Liu J., et al. Tracking the Learning Curve in Microsurgical Skill Acquisition. Plastic and Reconstructive Surgery. 2012;130(4):550e–557e. doi: 10.1097/PRS.0b013e318262f14a.
- Balasundaram I., Aggarwal R., Darzi L. A. Development of a training curriculum for microsurgery. British Journal of Oral and Maxillofacial Surgery. 2010;48(8):598–606. doi: 10.1016/j.bjoms.2009.11.010.
- Martin J. A., Regehr G., Reznick R., et al. Objective structured assessment of technical skill (OSATS) for surgical residents. British Journal of Surgery. 1997;84(2):273–278. doi: 10.1002/bjs.1800840237.
- Temple C. L. F., Ross D. C. A new, validated instrument to evaluate competency in microsurgery: The University of Western Ontario microsurgical skills acquisition/assessment instrument. Plastic and Reconstructive Surgery. 2011;127(1):215–222. doi: 10.1097/PRS.0b013e3181f95adb.
COMENTARIO
Los autores presentaron diferentes técnicas de ejercicio microquirúrgico utilizando placentas. El uso de placentas para entrenamiento en técnicas vasculares se fue popularizando hace algunos años.
La manipulación microquirúrgica de arterias y venas en animales continúa siendo la forma más fidedigna de imitar las maniobras que se realizaran en el quirófano con pacientes humanos. La permeabilidad de las anastomosis, la hermeticidad de las suturas vasculares y el latido de los aneurismas experimentales no se pueden imitar con ningún otro método y es la mejor manera de evaluar el éxito de un ejercicio microquirúrgico experimental.1
Como bien dicen los autores, la utilización de animales de laboratorio para entrenamiento vascular microquirúrgico requiere de un bioterio con cuidados veterinarios especializados que cumplan con las normas éticas en el manejo de animales. Lamentablemente pocas instituciones con residentes de neurocirugía pueden contar con tales facilidades en nuestro país.
La placenta es una alternativa válida al uso de animales de laboratorio y al mismo tiempo es mejor que los modelos virtuales y los materiales inertes. Remeda aunque sea en parte la manipulación de vasos cerebrales. Permite además con creatividad, desarrollar diferentes modelos de entrenamiento.2-3
Felicito a los autores y los desafío a continuar con la técnica de disección placentaria en nuestro medio.
Flavio Requejo
Hospital “Prof. Dr. Juan P. Garrahan”
BIBLIOGRAFÍA
1 Requejo, Flavio & del Rio, Ramiro & Asprea, Marcelo & Williams, Gustavo & Zuccaro, Graciela. (2009). Aneurismas experimentales en ratas. Revista argentina de neurocirugía. 23.
2 Kwok JC, Huang W, Leung WC, et al. Human placenta as an ex vivo vascular model for neurointerventional research. J Neurointerv Surg. 2014;6(5):394-399. doi:10.1136/neurintsurg-2013-010813
3 de Oliveira MMR, Ferrarez CE, Ramos TM, et al. Learning brain aneurysm microsurgical skills in a human placenta model: predictive validity. J Neurosurg. 2018;128(3):846-852. doi:10.3171/2016.10.JNS162083
COMENTARIO
En este artículo los autores presentan un modelo de entrenamiento microquirúrgico basado en la utilización de placentas humanas. Para esto utilizaron 15 placentas preparadas con técnicas especiales de coloración y preservación vascular con silicona en las que realizaron ejercicio de anastomosis vasculares y disecciones parenquimatosas placentarias remedando la disección del valle silviano y la resección de tumores intraparenquimatosos. Para poder simular con mayor realismo el escenario quirúrgico, los autores utilizaron modelos craneales 3D que permitieron simular el abordaje quirúrgico y desarrollar una coordinación visomotriz adaptable a los diferentes planos de profundidad existentes en una microcirugía cerebral.
Este entrenamiento está presentado por los autores como una herramienta de desarrollo y afianzamiento de las habilidades neuroquirúrgicas durante la etapa de formación asociada a la residencia.
En el artículo los autores reconocen los importantes cambios que se han generado en la formación profesional de nuestra especialidad a lo largo de los últimos años. Actualmente, la mayor importancia dada a la calidad de vida de los pacientes ha llevado el foco de atención sobre la efectividad y la seguridad de los tratamientos neuroquirúrgicos, originando una reflexión sobre los factores que pudieran alterar el resultado quirúrgico originando efectos adversos indeseados. Uno de los elementos surgidos de este análisis se relaciona con la necesidad de asegurar que el cirujano cuente con las competencias específicas para realizar adecuadamente una determinada cirugía. La necesidad, ética y legal, de asegurar esta competencia, ha influido directamente en el volumen de cirugías realizadas en nuestros días por los residentes haciendo necesario un cambio de paradigma en la estructuración del proceso de enseñanza de una residencia de neurocirugía 1.
Hasta hace unos años el modelo utilizado se basaba en una fuerte carga horaria y la adquisición de experiencia quirúrgica mediante una exposición circunstancial a un gran volumen de cirugías. Actualmente, el nuevo paradigma de formación utiliza un proceso de “practicas intencionales y dirigidas” que llevan el residente a alcanzar competencias especificas en diferentes dominios: el cuidado de los pacientes, el conocimiento médico, las habilidades de comunicación interpersonal y las competencias quirúrgicas 2.
Estos nuevos programas de formación de residentes basados en el entrenamiento de las habilidades quirúrgicas y una exposición controlada del residente a cirugías de complejidad creciente, hace que el aprendizaje sea más consistente y efectivo y desemboque en una mejor formación y mejores resultados quirúrgicos.
Lamentablemente, la realidad de nuestro país hace que algunos de los Hospitales que cuentan con un programa de residencias no puedan asegurar una adecuada cantidad, tipología y distribución de cirugías y a veces tampoco un programa de formación estructurado de calidad que pueda enfrentar adecuadamente este cambio de paradigma. La Asociación Argentina de Neurocirugía está trabajando denodadamente sobre este problema, pero su discusión está más allá de este comentario.
En estos casos, coincido con los autores que el desarrollo y afianzamiento de esas competencias pueden ser alcanzadas solamente mediante la utilización de métodos supletorios realizados en el laboratorio a través de simuladores y el trabajo en placentas es claramente una de estas posibilidades.
Como concepto final quiero remarcar que el trabajo de laboratorio está claramente ligado a un momento de aprendizaje. Si bien el periodo de la residencia, o de lo primeros años de ejercicio profesional, son los momentos más activos de aprendizaje, es importante entender que el trabajo de laboratorio nos tiene que acompañar durante toda nuestra vida como neurocirujano. La técnica microquirúrgica aplicada a la patología vascular está más viva que nunca y las nuevas posibilidades terapéuticas ofrecidas por el desarrollo de múltiples y diferentes tipos de by-pass cerebrales es un ejemplo de ello 3,4. Para poder realizarlos, se requiere de habilidades técnicas específicas, delicadas y detallistas y el trabajo en el laboratorio es el camino a seguir para alcanzarlas. Considero este artículo una ayuda valedera para poder transitarlo.
BIBLIOGRAFÍA
- Chowdhry, Spetzler RF: Genealogy of Training in Vascular Neurosurgery. Neurosurgery 74: S198–S203, 2014
- Neurological Surgery Milestone Working Group: The Neurological Surgery Milestone Project. The Accreditation Council for Graduate Medical Education and The American Board of Neurological Surgery, 2013. http://www.acgme.org/ acgmeweb/Portals/0/PDFs/Milestones/NeurologicalSurgeryMilestones.pdf
- Lawton MT, Lang, MJ: The future of open vascular neurosurgery: perspectives on cavernous malformations, AVMs, and bypasses for complex aneurysms. J Neurosurg 130(5): 1409-1425, 2019
- Alvi MA, Rinaldo L, Kerezoudis P, Rangel-Castilla L, Bydon M, Cloft H, Lanzino G: Contemporary trends in extracranial-intracranial bypass utilization: analysis of data from 2008 to 2016. J Neurosurg. 2019 Nov 15:1-9 doi: 10.3171/2019.8. JNS191401. Epub ahead of print. PMID: 31731270






