Hemorragia subaracnoidea aneurismática y craniectomía descompresiva primaria: guía de manejo tras 13 años de experiencia en un centro de referencia
Silvina A. Martínez,1 Flor Montilla,1 María Guevara,1 Sebastián Frascarolli,1 Clara Martin,1 Pablo Rubino1,2
1. Servicio de Neurocirugía, Hospital de Alta Complejidad en Red “El Cruce”, Buenos Aires, Argentina
2. Servicio de Neurocirugía, Hospital Alemán, Ciudad de Buenos Aires, Argentina
Recibido: 24/02/25 Aceptado: 30/05/25
Silvina A. Martínez
silvii_cb@hotmail.com
DOI: 10.59156/revista.v39i02.718
ORCID
Silvina A. Martínez: 0000-0001-6624-2908
Flor Montilla: 0009-0004-6040-7619
María Guevara: 0009-0004-7178-7063
Sebastián Frascarolli: 0009-0000-4032-3769
Clara Martin: 0009-0007-4453-5129
Pablo Rubino: 0000-0002-2621-8441
EMAILS
Flor Montilla: florimontilla03@hotmail.com
María Guevara: mariaguevara.na@gmail.com
Sebastián Frascarolli: frascarolli.se@gmail.com
Clara Martin: cla.martinb@gmail.com
Pablo Rubino: parubino@hotmail.com
Los autores no declaran conflicto de interés
Los autores no declaran financiamiento.
Este es un artículo de acceso abierto bajo la licencia CC BY-NC https://creativecommons.org/licenses/by-nc/4.0/
RESUMEN
Introducción: la craniectomía descompresiva es una herramienta terapéutica eficaz para controlar la hipertensión endocraneana, indicada tanto en forma primaria ante predictores clínicos y por imágenes, como en forma tardía cuando la hipertensión se vuelve refractaria. En el contexto de hemorragia subaracnoidea aneurismática, la hipertensión puede presentarse de manera inmediata o diferida, vinculada a edema cerebral, hidrocefalia, hematomas o infartos por vasoespasmo. En casos que requieren clipado microquirúrgico urgente, la decisión de asociar una craniectomía descompresiva debe basarse en el estado clínico, las imágenes preoperatorias y los hallazgos intraoperatorios, sin demorar el tratamiento del aneurisma roto.
Objetivos: evaluar la indicación de craniectomía descompresiva primaria en pacientes con hemorragia subaracnoidea sometidos a clipado microquirúrgico e identificar factores predictivos de reintervención precoz y su impacto en el resultado funcional.
Material y métodos: análisis retrospectivo de los pacientes con HSA admitidos en nuestro centro entre 2011-2024 tratados con clipado y que requirieron craniectomía descompresiva primaria o dentro de las 48 horas del clipado. Se analizó el manejo en cada caso. Se utilizaron las pruebas de Chi-cuadrado o la exacta de Fisher, según correspondiera, para establecer la asociación entre variables. Se evaluó el resultado funcional a los 6 meses utilizando la escala de Rankin modificada (RS-m).
Resultados: se obtuvieron 113 HSA tratadas con clipado que requirieron craniectomía descompresiva en las primeras 48 horas: 87.6% primarias y 12.4% secundarias. La indicación se asoció al mal grado neurológico, presencia de hidrocefalia, hematoma con efecto de masa, y herniación del cerebro en la cirugía. La manifestación de hematoma con efecto de masa, el mal grado neurológico y la herniación del cerebro al finalizar el clipado presentaron una asociación estadísticamente significativa con un RS-m desfavorable. El cerebro “relajado” al finalizar el clipado puede subestimar el edema cerebral, y hay que contextualizarlo con otras variables.
Conclusión: presentamos el abordaje institucional como guía orientativa para el manejo de estos casos. Este subgrupo de pacientes se asocia a una elevada morbimortalidad, por lo que la identificación temprana de candidatos a craniectomía descompresiva podría modificar significativamente su evolución clínica.
Palabras clave: Clipado. Craniectomía descompresiva. Hemorragia subaracnoidea. Morbimortalidad
Aneurysmal subarachnoid hemorrhage and primary decompressive craniectomy: management guidelines based on 13 years of experience at a referral center
ABSTRACT
Background: decompressive craniectomy is an effective therapeutic tool for controlling intracranial hypertension, indicated both primarily based on clinical and imaging predictors, and later when hypertension becomes refractory. In the context of aneurysmal subarachnoid hemorrhage, hypertension may present immediately or delayed, associated with cerebral edema, hydrocephalus, hematomas, or infarcts due to vasospasm. In cases requiring urgent microsurgical clipping, the decision to combine decompressive craniectomy should be based on clinical status, preoperative imaging, and intraoperative findings, without delaying treatment of the ruptured aneurysm.
Objectives: to evaluate the indication for primary decompressive craniectomy in patients with subarachnoid hemorrhage undergoing microsurgical clipping and to identify predictors of early reintervention and their impact on functional outcome.
Methods: retrospective analysis of patients with SAH admitted to our center between 2011 and 2024 treated with clipping and requiring decompressive craniectomy either primary or within 48 hours of clipping. Management was analyzed in each case. The Chi-square test or Fisher's exact test was used, as appropriate, to establish the association between variables. Functional outcome was assessed at 6 months using the modified Rankin Scale (mRS).
Results: a total of 113 SAHs treated with clipping required decompressive craniectomy within the first 48 hours: 87.6% primary and 12.4% secondary. The indication was associated with poor neurological grade, presence of hydrocephalus, hematoma with mass effect, and brain herniation at the time of surgery. The presence of a hematoma with mass effect, poor neurological grade, and brain herniation at the end of clipping were statistically significantly associated with an unfavorable mRS. A "relaxed" brain at the end of clipping may underestimate cerebral edema and must be contextualized with other variables.
Conclusion: we present the institutional approach as a guideline for the management of these cases. This subgroup of patients is associated with high morbidity and mortality, so early identification of candidates for decompressive craniectomy could significantly modify their clinical course.
Keywords: Clipping. Decompressive craniectomy. Morbidity and mortality. Subarachnoid hemorrhage
INTRODUCCIÓN
La craniectomía descompresiva es una medida conocida y eficaz para reducir la hipertensión endocraneana. Existen predictores clínicos y por imágenes en contexto de traumatismo encefalocraneano grave y de ACV isquémico maligno que justifican la craniectomía descompresiva primaria,1-3 en contrapartida de la craniectomía descompresiva como última medida, cuando la hipertensión endocraneana se vuelve refractaria, posterior al monitoreo invasivo de presión intracraneana y manejo médico.
En contexto de hemorragia subaracnoidea (HSA), la hipertensión endocraneana puede producirse inmediatamente luego del sangrado debido a edema cerebral primario, o bien como consecuencia de hidrocefalia aguda, o ante la presencia de hematomas con efecto de masa. A su vez, puede producirse en forma diferida ante edema cerebral secundario, resangrado, infartos cerebrales por vasoespasmo o hidrocefalia.1,4
El resangrado se asocia a un aumento de la mortalidad y a una mala evolución clínica. Se recomienda una evaluación inmediata, la identificación del aneurisma y su tratamiento, preferentemente dentro de las primeras 24 horas. El objetivo debe ser la obliteración completa –siempre que sea posible– para reducir el riesgo de nuevas hemorragias y de retratamiento.3
En los pacientes a los que el aneurisma se tratará por vía microquirúrgica de urgencia, no se aguarda a la monitorización de PIC (presión intracraneana) invasiva, ya que no se debe demorar el tratamiento del aneurisma. La decisión de realizar una craniectomía descompresiva en el mismo acto operatorio del clipado aneurismático continúa quedando a criterio del neurocirujano, sobre la base de su experiencia ante el estado clínico preoperatorio, imágenes de ingreso y hallazgos intraquirúrgicos.1,2
Objetivos
Evaluar la indicación de craniectomía descompresiva primaria en pacientes con hemorragia subaracnoidea sometidos a clipado microquirúrgico e identificar factores predictivos de reintervención precoz y su impacto en el resultado funcional.
MATERIALES Y MÉTODOS
Se realizó un análisis observacional retrospectivo y analítico de los pacientes con HSA admitidos en nuestro centro entre 2011 y 2024. De ellos, se incluyeron aquellos tratados con clipado microquirúrgico que requirieron craniectomía descompresiva en algún momento de su internación. Se excluyeron pacientes tratados por vía endovascular, con bypass cerebral, aneurismas de circulación posterior y casos con craniectomía menor a 12 cm.
Los pacientes se clasificaron en 1) craniectomía descompresiva primaria (CDP) (en el momento del clipado), 2) craniectomía descompresiva dentro de las 48 horas posterior al clipado (CD secundaria precoz, CDSP) y 3) craniectomía descompresiva posterior a las 48 horas del clipado (secundaria tardía, CDST). El grupo “3” fue excluido por no corresponder con el objetivo del trabajo.
Se analizó el manejo, el abordaje quirúrgico y la toma de decisión en cada caso.
Se evaluaron: ubicación del aneurisma, escala de Hunt y Hess (H y H) y World Federation of Neurological Surgenos (WFNS) (considerando buen grado neurológico 1-3 y mal grado 4-5 de estas últimas dos escalas), escala de Fisher modificada (Fisher-m), presencia de hematoma con efecto de masa, hidrocefalia aguda, tiempo entre el sangrado y clipado, rotura aneurismática intraoperatoria, herniación del cerebro en la apertura dural o al momento del cierre y período de vasoespasmo (día 3-21 del sangrado) al momento del clipado.5,6
Se analizaron la asociación entre las variables y la realización de craniectomía descompresiva primaria. Las mismas variables se examinaron en los pacientes que requirieron CD en las primeras 48 horas y si algún factor pudo predecir esa rápida evolución a HTE que se hubiera beneficiado de una CD primaria. Se evaluó el resultado funcional a los 6 meses, considerando un resultado favorable una Rankin modificada (RS-m) 0-3 (entendida como aquellos que alcanzan una vida independiente) y desfavorable una RS-m de 4-6. Se analizó la asociación entre la RS-m a los 6 meses con cada una de las variables analizadas y con los dos grupos 1 y 2 de CD.
Se realizó el análisis estadístico comparando proporciones con la prueba de Chi-cuadrado o la exacta de Fisher, según correspondiera. Se estableció como significativo un valor de p <0.05.
RESULTADOS
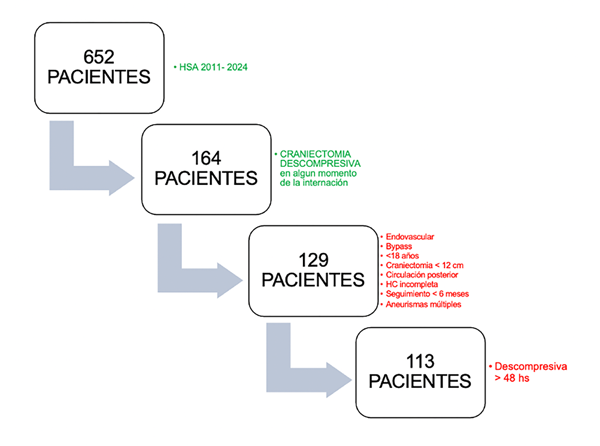
En el período 2011-2024 se admitieron 652 HSA en nuestro centro. De ellos, se obtuvieron 113 pacientes aplicando los criterios de inclusión y exclusión (Figura 1).

Figura 1. Criterios de inclusión y exclusión.
Análisis de las variables
Craniectomía descompresiva primaria versus secundaria
El 87.6% fueron craniectomizados en el mismo acto quirúrgico del clipado (CDP). En el 12.4% de los pacientes restantes se realizó el clipado microquirúrgico reponiendo la plaqueta ósea, los que evolucionaron con hipertensión endocraneana refractaria al tratamiento médico requiriendo CD dentro de las 48 horas posterior al clipado (CDSP).
Se encontró una asociación estadísticamente significativa entre el grupo que se sometió a CD secundaria precoz y resultados favorables medidos en RS-m a los 6 meses (Tablas 1 y 2).
TABLA 1. ASOCIACIÓN ENTRE VARIABLES Y RS-m Y NECESIDAD DE CRANIECTOMÍA DESCOMPRESIVA PRIMARIA
Variable |
n (total = 113) |
n (%) |
Valor p RS-m no favorable |
OR IC RS-m desfavorable |
valor p CDP |
OR IC CDP |
Hunt y Hess mal grado |
92 |
81.40% |
<0.012* |
4.103 (1.408-11.954) |
<0.001* |
0.037 (0.009-0.156) |
WFNS mal grado |
92 |
81.40% |
0.055* |
3.038 (1.031-8.951) |
<0.001* |
0.037 (0.009-0.156) |
Fisher modificada 3 y 4 pts |
105 |
92.90% |
0.63* |
0.23* |
||
Hidrocefalia aguda |
29 |
25.70% |
0.523ª |
0.002* |
0.845 (0.771-0.926) |
|
Hematoma con efecto de masa |
58 |
51.30% |
0.002ª |
5.538 (1.718- 17.854) |
0.145ª |
|
Tiempo sang-CX |
0.972ª |
0.787ª |
||||
Tiempo sang-CX <24 h |
72 |
63.70% |
||||
Tiempo sang-CX 24—72 h |
19 |
16.80% |
||||
Tiempo sang-CX >72 h |
22 |
19.50% |
||||
Período de vasoespasmo |
38 |
33.60% |
0.197ª |
0.213* |
||
Ruptura aneurismática CX |
23 |
20.40% |
0.999* |
0.067* |
||
Herniación al abrir duramadre |
106 |
93.80% |
0.605* |
0.003* |
0.070 (0.013 – 0.361) |
|
Herniación al cerrar |
81 |
71.70% |
0.004ª |
4.190 (1.532 – 11.461) |
<0.001* |
0.594 (0.446 – 0.791) |
Localización |
0.160ª |
0.917ª |
||||
Paraclinoideo |
5 |
4% |
||||
Comunicante posterior |
29 |
26% |
||||
Coroideo |
1 |
1% |
||||
Bifurcación carotídea |
2 |
2% |
||||
Comunicante anterior |
32 |
28% |
||||
Pericalloso |
5 |
4% |
||||
Cerebral media |
39 |
35% |
TABLA 2. CARACTERÍSTICAS DE LOS PACIENTES QUE REQUIRIERON CD SECUNDARIA PRECOZ (CDSP)
Variable |
n (total = 13) |
n (%) |
Hunt y Hess buen grado |
10 |
76.92% |
Hunt y Hess mal grado |
3 |
23.02% |
WFNS buen grado |
10 |
76.92% |
WFNS mal grado |
3 |
23.02% |
Fisher modificada 1 y 2 pts |
2 |
15.39% |
Fisher modificada 3 y 4 pts |
11 |
84.61% |
Hidrocefalia aguda |
0 |
0.00% |
Sin hidrocefalia |
13 |
100.00% |
Hematoma con efecto de masa |
4 |
30.76% |
Sin hematoma con efecto de masa |
9 |
69.24% |
Tiempo sang-CX <24 h |
8 |
61.50% |
Tiempo sang-CX 24—72 h |
3 |
23.07% |
Tiempo sang-CX > 72 h |
2 |
15.38% |
Período de vasoespasmo |
2 |
15.38% |
Fuera de período de vasoespasmo |
11 |
84.62% |
Sin ruptura aneurismática |
13 |
100.00% |
Ruptura aneurismática CX |
0 |
0.00% |
Sin herniación al abrir la duramadre |
4 |
30.77% |
Herniación al abrir duramadre |
9 |
69.23% |
Sin herniación al cerrar |
13 |
100.00% |
Herniación al cerrar |
0 |
0.00% |
Paraclinoideo |
1 |
8% |
Comunicante posterior |
3 |
23% |
Coroideo |
0 |
0% |
Bifurcación carotídea |
0 |
0% |
Comunicante anterior |
5 |
38% |
Pericalloso |
0 |
0% |
Cerebral media |
4 |
31% |
Escala de Hunt y Hess y WFNS
El 81% de las HSA fueron clasificadas de mal grado neurológico y 19% de buen grado acorde a las escalas de H y H y WFNS. Se encontró una asociación estadísticamente significativa entre el mal grado neurológico al ingreso y la necesidad de CDP. A su vez, se asoció a una evolución no favorable en RS-m a los 6 meses. Esto último fue estadísticamente significativo cuando el mal grado se evaluó con la escala de H y H, sin embargo, no alcanzó significación estadística por la escala de WFNS (ver Tabla 1).
Escala de Fisher modificada
Con respecto a la clasificación de Fisher modificada, 3 pacientes obtuvieron 1 punto, 5, 2 puntos; 34 pacientes 3 puntos y 71, 4 puntos (Figura 2).

Figura 2. Puntuación en la escala de Fisher modificada de la población analizada.
No se encontró diferencia estadísticamente significativa entre la puntuación en la escala de Fisher-m y la necesidad de craniectomía primaria/secundaria ni tampoco con la RS-m a los 6 meses (ver Tabla 1).
Ubicación del aneurisma roto
La ubicación más frecuente del aneurisma responsable de la hemorragia subaracnoidea fue la arteria cerebral media (35%), seguida del comunicante anterior (28%), comunicante posterior (26%), pericalloso y paraclinoideo (4%), bifurcación carotídea (2%), y coroideo anterior (1%) (Figura 3).

Figura 3. Ubicación del aneurisma responsable del sangrado en la población analizada.
No hubo diferencias estadísticamente significativas entre la ubicación del aneurisma y la necesidad de CD primaria o secundaria ni con la RS-m a los 6 meses (ver Tabla 1).
Presencia de hidrocefalia aguda al ingreso
Veintinueve pacientes (25.6%) se presentaron con hidrocefalia aguda, 28 de ellos de mal grado neurológico. Todos se trataron con ventriculostomía y CD primaria además del clipado. No se encontraron diferencias estadísticamente significativas entre la presencia de hidrocefalia y el resultado de la RS-m a los 6 meses. La mortalidad en este grupo de pacientes fue del 62%.
Presencia de hematoma con efecto de masa
Cincuenta y ocho pacientes (51.3%) presentaron hematoma con efecto de masa, 49 de ellos (84.5%) ingresaron con mal grado neurológico. De los 58 pacientes, 54 necesitaron una CDP y 4, CDSP. La presencia de un hematoma con efecto de masa se asoció a una RS-m desfavorable a los 6 meses (ver Tabla 1).
Tiempo ocurrido entre el sangrado y el clipado
Setenta y dos pacientes (62%) fueron operados dentro de las primeras 24 horas del sangrado (grupo 1); 19 pacientes (17%) entre las 24 y 72 horas (grupo 2), y 22 (19%) pasadas las 72 horas del sangrado (grupo 3). No se encontraron diferencias estadísticamente significativas entre el tiempo que demoró la intervención con la realización de CD primaria/secundaria ni con la RS-m a los 6 meses (ver Tabla 1).
Período de vasoespasmo al momento de la cirugía
Consideramos el período de vasoespasmo entre los días 3 y 21 posteriores al sangrado. De los pacientes analizados, 75 (66.4%) se operaron antes del día 3, mientras que 38 (33.6%) dentro del período mencionado. No se encontraron diferencias estadísticamente significativas entre operarse dentro del período de vasoespasmo con la realización de CD primaria/secundaria ni con la RS-m a los 6 meses (ver Tabla 1).
Rotura aneurismática en la cirugía
La rotura del aneurisma en la cirugía de clipado se produjo en el 20.35% de los pacientes. No se encontraron diferencias estadísticamente significativas entre la rotura aneurismática con la realización de CD primaria/secundaria ni con la RS-m a los 6 meses (ver Tabla 1).
Herniación del parénquima cerebral al abrir la duramadre
En el 93.8% de los pacientes, el parénquima se encontró herniado por fuera de los límites de la craneotomía al momento de la apertura dural. Esto presentó una asociación estadísticamente significativa con la necesidad de craniectomía descompresiva primaria. No se encontraron diferencias estadísticamente significativas entre la herniación del parénquima al abrir la duramadre y la RS-m a los 6 meses (ver Tabla 1).
Herniación del parénquima cerebral al momento del cierre
El 71.7% de los pacientes presentaba el cerebro herniado por fuera de los límites de la craneotomía al momento del cierre. En todos estos casos se decidió ampliar a craniectomía descompresiva en el mismo acto quirúrgico, por lo que esta asociación fue estadísticamente significativa. También se observó una asociación entre el parénquima herniado al cierre con peor resultado funcional en la RS-m a los 6 meses (ver Tabla 1).
Manejo y abordaje quirúrgico
Los pacientes con diagnóstico de hemorragia subaracnoidea por tomografía computada o por punción lumbar fueron sometidos a angiotomografía de ingreso o angiografía por sustracción ósea digital, acorde a la disponibilidad del método. Se identificaron la ubicación del aneurisma y la posibilidad de clipado microquirúrgico versus resolución endovascular de urgencia para evitar el resangrado. Los pacientes resueltos por vía endovascular fueron excluidos del trabajo. Se explicaron claramente el pronóstico y las complicaciones al paciente y familiares, según el caso, los que dieron su consentimiento informado. Acorde a los hallazgos clínicos y tomográficos se planificó el abordaje quirúrgico de la siguiente manera:
Aneurismas del segmento supraclinoideo de la carótida, bifurcación carotídea, comunicante anterior y silvianos, en los pacientes con variables prequirúrgicas favorables (buen grado neurológico, clasificación de Fisher-m 1 o 2, escaso tiempo desde el sangrado y resolución previa al período de vasoespasmo, deterioro neurológico atribuible a otra causa), se practicó un abordaje pterional del lado del aneurisma a abordar. En caso de aneurismas de comunicante anterior, se eligió el lado acorde a un análisis detallado que excede los objetivos del presente trabajo. En caso de hidrocefalia se colocó un drenaje ventricular externo contralateral, previo al abordaje pterional. En los pacientes con variables prequirúrgicas desfavorables (mal grado neurológico, clasificación de Fisher-m 3 o 4, resolución durante el período de vasoespasmo, ausencia de otra causa de deterioro neurológico), la incisión en piel se realizó en forma de signo de interrogación, con craneotomía con las dimensiones y localización del abordaje pterional.
Posteriormente, en ambos abordajes, se efectuó la apertura dural y se observó el comportamiento del cerebro y si se encontraba herniado sobre los bordes de la craneotomía. Se continuó con la evacuación de líquido cefalorraquídeo de las cisternas basales y con la fenestración de la lamina terminalis. Se realizó el clipado del aneurisma responsable del sangrado. Se evacuó el hematoma intracerebral con efecto de masa en los casos que se encontrara presente y accesible con el mismo abordaje.
Al momento del cierre se evaluaron los hallazgos intraoperatorios: si el cerebro se encontraba herniado al momento de la apertura dural, si continuaba herniado al momento del cierre o se encontraba “relajado” y si había habido rotura aneurismática.
Ante el análisis de todos estos factores se decidió la reposición de la plaqueta ósea, o no reponerla y ampliar la craniectomía con dimensiones de descompresiva. En los casos de abordaje pterional, con una descarga lineal hacia parietal en piel, y en los casos de abordaje en signos de interrogación sin necesidad de ampliar la incisión (Figura 4).
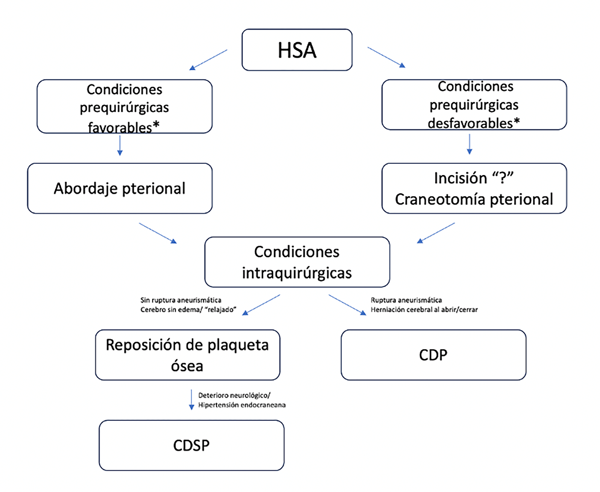
Figura 4. Diagrama de flujo. *Condiciones prequirúrgicas favorables: buen grado neurológico, clasificación de Fisher-m 1 o 2, escaso tiempo desde el sangrado y resolución previa al período de vasoespasmo, deterioro neurológico atribuible a otra causa corregible por otro abordaje, por ejemplo, hidrocefalia. *Condiciones prequirúrgicas desfavorables: mal grado neurológico, clasificación de Fisher-m 3 o 4, resolución durante el período de vasoespasmo, ausencia de otra causa del deterioro corregible por otro abordaje.
Aneurismas pericallosos
Se realizó un abordaje bicoronal en todos los casos y una craneotomía para un abordaje interhemisférico anterior. Teniendo en cuenta los mismos factores ya mencionados, se decidió la ampliación a una craniectomía descompresiva bifrontotemporal, o no. En todos los casos que lo requerían se colocó monitoreo de PIC.
DISCUSIÓN
Es sabido que la exclusión precoz del aneurisma roto mediante técnicas endovasculares o clipado microquirúrgico para evitar que vuelva a sangrar ha reducido la mortalidad en pacientes con HSA. Se recomienda una evaluación inmediata, la identificación del sitio de sangrado y el tratamiento del aneurisma roto, preferentemente dentro de las primeras 24 horas. El abordaje temprano de los aneurismas rotos reduce el riesgo de resangrado y facilita el tratamiento de la isquemia cerebral tardía.3
En este contexto, cuando se resuelve el aneurisma por vía microquirúrgica de urgencia, no aguardamos a la monitorización de PIC invasiva ya que no debemos demorar el tratamiento del aneurisma. Por ello, en la cirugía de clipado se debe tomar la decisión de realizar una CD o reponer la plaqueta ósea sin conocer los valores previos de PIC.
HSA de mal grado
No cabe duda de que el mal grado clínico se asocia a una evolución desfavorable tras una HSA. El tratamiento de estos pacientes sigue siendo un gran reto.2,3,7,8 Pueden ser candidatos a tratamiento aneurismático siempre que no presenten lesiones neurológicas irrecuperables y devastadoras. Aquellos con edad avanzada requieren una consideración cuidadosa del tratamiento, la toma de decisiones compartida y la discusión del pronóstico con la familia.3 Hay reportes que oscilan entre 20-40% de resultados favorables en HSA de mal grado, en comparación con un 5% reportado cuando quedan librados a su evolución natural. Esto motiva un enfoque agresivo.2,3,7,8
Otro punto de discusión es si, además del efecto en la reducción de la mortalidad de la CD como “cirugía de salvataje”, contribuye a mejorar los resultado funcionales a largo plazo con menores tasas de discapacidad grave y de dependencia de los pacientes.
Brandecker y cols. proponen la hipótesis de que la CD primaria podría mejorar los resultados funcionales en pacientes con HSA de mal grado al proporcionar una reducción temprana de la presión intracraneana y mejorar la perfusión cerebral y reducir el daño secundario.2 En una cohorte de 87 pacientes, compararon un grupo de CD primaria de 38 pacientes con 49 con CD secundaria. Observaron una reducción en la mortalidad, pero no encontraron diferencias en los resultados funcionales en ambos grupos. Los autores aclararon que el grupo de CD primaria presentaba peores condiciones clínicas iniciales (signos de herniación cerebral, hematomas con efecto de masa, y HSA grado 5), lo que podría condicionar la ausencia de beneficio de la intervención. También realizaron una revisión sistemática de la bibliografía, donde sí notaron una diferencia en los resultados funcionales de los pacientes a favor de la CD primaria, destacando que esta debe ser inmediata con respecto al deterioro neurológico.
Jabbarli y cols. dividieron a los pacientes en un grupo de CD primaria temprana (<24 h del ictus) y tardía (>24 h). Reportaron resultados favorables en el 40% del primer grupo versus 22% del segundo.8 También, un mayor beneficio funcional en los grados menores a 5, considerando que estos podrían presentar daños irreparables. Sin embargo, también refirieron beneficio de la intervención en este grupo, aunque en un porcentaje menor. Los autores destacaron el tiempo real que transcurre entre el ictus y la CD, este es crucial para la mejoría funcional de los pacientes con HSA que la requieren.
En el análisis de nuestra experiencia, los pacientes con HSA de mal grado se asociaban a Fisher-m 3 y 4 y con hallazgos intraoperatorios al abrir la duramadre del cerebro herniado y muy edematizado. Por este motivo se prefiere un abordaje en piel en signo de interrogación ya que si se confirman los hallazgos intraoperatorios se completa la CD.
Teniendo en cuenta que las escalas de H y H y WNSF son clínicas, prestamos especial atención a otras causas de deterioro neurológico que no se relacionen con la posibilidad de estar sufriendo hipertensión endocraneana o que puedan ser resueltas por otro abordaje. La guía de la AHA/ASA para el manejo de estos pacientes sugiere identificar precozmente factores modificables que puedan llevar a resultados más favorables como convulsiones, hidrocefalia, anomalías electrolíticas como la hiponatremia, etc.3
HSA de buen grado
Este subgrupo de pacientes incluye desde asintomáticos a aquellos con GCS 13/15 con hemiparesia para la escala de WFNS, o pacientes con tendencia al sueño, confusión y foco motor leve para la escala de Hunt y Hess. Ante este examen físico neurológico, no pensaríamos en monitoreo de PIC o la realización de una craniectomía descompresiva. ¿Hay alguna forma de predecir algún subgrupo de estos pacientes que evolucione rápidamente con deterioro neurológico y vaya a requerir una CD precoz?
Jabbarli y cols. destacan que el beneficio de la CD precoz sería mayor incluso en los pacientes con mejor grado neurológico, encontrando que el subgrupo de grado 5 podría presentar daños irreparables. Por el contrario, en aquellos por debajo del grado 5, la CD precoz resultó beneficiosa no solo en cuanto a los resultados funcionales, sino también respecto de las tasas de mortalidad intrahospitalaria e infarto cerebral. Subrayaron también la importancia de desarrollar indicaciones precisas de CD precoz, no limitadas a los pacientes en mal estado clínico inicial.
Darkwah Oppong y cols. coinciden en que incluso los pacientes de buen grado parecen beneficiarse más de la CDP que de la CDS, por ello podría ser crucial identificar a estos pacientes en una fase temprana del curso clínico.1 Los individuos más jóvenes con HSA de buen grado presentan mejores resultados tras la CD. Especialmente en estos casos, la CDP parece ser superior a la CDS en lo que respecta a los resultados.
En nuestra experiencia, los pacientes con CDSP se asociaron a mejores resultados funcionales que los de CDP. Esto podría explicarse por el predominio de pacientes de buen grado neurológico en el grupo de CDSP (76.9%) que podrían tener por su condición neurológica inicial mejor pronóstico funcional a largo plazo.
Analizando las historias clínicas retrospectivamente, observamos que decidimos recolocar la plaqueta ósea debido a que eran pacientes con HSA de buen grado y con el cerebro “relajado” al momento del cierre. Teniendo en cuenta la evolución posterior, deberíamos considerar con especial atención si en la tomografía inicial presentan Fisher-m 3 o 4 (la que se observa en el 84.61% de estos pacientes) y el cerebro se encuentra herniado al momento de la apertura dural (hallazgo encontrado en el 69.23% de las CDSP) (ver Tabla 2).
También consideramos, en nuestra cohorte, aquellos pacientes que en el tiempo entre el ingreso hospitalario y el ingreso a quirófano presentaron deterioro neurológico (por ejemplo ingreso 15/15 y a quirófano 13/15). Este dato no se encontraba bien documentado por lo que no se incluyó en el análisis estadístico.
Escala de Fisher modificada
La bibliografía reporta peor evolución a valores más altos de esta escala, y una mayor incidencia de injuria cerebral tardía en estos pacientes.6,9
Si bien no encontramos diferencias estadísticamente significativas en cuanto a morbimortalidad y en la indicación de CDP y CDSP, esto podría explicarse por la distribución de los pacientes, en su mayoría, en las categorías 3 y 4, grados con predominio de mal estado neurológico. Por lo que podría tratarse de un sesgo en la distribución. En la práctica, asociamos los puntajes más altos de la escala de Fisher-m con la presencia del cerebro edematizado y herniado en la cirugía. Identificamos puntajes de 3 y 4 en el 84.61% de los pacientes que necesitaron una CDSP.
Hallazgos intraoperatorios
Según lo analizado en las historias clínicas y partes quirúrgicos, la evacuación de líquido cefalorraquídeo de las cisternas, y al abrir lamina terminalis así como evacuación de hematomas en caso de estar presentes, favoreció la relajación del cerebro contribuyendo a la decisión de recolocar el hueso al momento del cierre. Observamos que estos pacientes presentaban PIC dentro de valores normales en el postoperatorio inmediato, pero que rápidamente elevaban los valores volviéndose refractarios al tratamiento médico y requiriendo una reintervención para ampliar a una CD. Por lo que creemos que la relajación del cerebro al momento del cierre como único parámetro no sería indicada para decidir recolocar la plaqueta ósea, ya que puede subestimar el edema cerebral. En cambio, si ante la apertura dural no se encontraba herniado, pero durante el procedimiento ocurrieron eventos que hicieran que al cierre sí lo esté (rotura aneurismática, retracción cerebral prolongada, etc.), debería categorizarse este hallazgo y considerar la CD. En resumen, el estado del cerebro al momento del cierre debe ser tenido en cuenta si se encuentra herniado, pero no considerarlo como único factor si se encuentra relajado.
Cabe destacar que algunos factores como las condiciones friables o contusas del parénquima, el efecto de la retracción estática, espasmo por manipulación durante la cirugía, entre otros, no se encontraban bien documentados en las historias clínicas por lo que no fueron ponderados en el análisis y podrían contribuir a generar edema postoperatorio.
Hematoma con efecto de masa
Los pacientes con HSA que se presentan con hematomas intracerebrales suelen concomitar con HTE y signos de herniación cerebral, por lo que se asocian a la necesidad de CD para reducir la PIC producto del efecto de masa o del edema cerebral asociado.1,4,10 Ota y cols. reportan esta variable como un factor de riesgo independiente de peor evolución debido a que se produciría una destrucción intraaxial de estructuras y causaría una injuria irreversible.11 Especialmente los aneurismas silvianos, por la ubicación anatómica del hematoma, podrían afectar áreas elocuentes con impacto en la evolución funcional a largo plazo.
Los resultados obtenidos en nuestra casuística coinciden con una mayor morbimortalidad estadísticamente significativa ante la presencia de hematomas con efecto de masa.
Hidrocefalia aguda
Según lo reportado en la bibliografía, las tasas de mortalidad y de infarto cerebral son más elevadas en los pacientes con HSA e hidrocefalia aguda que en los que no la padecen, y también se asocian a peor grado neurológico y tomográfico y a mayor estadía hospitalaria.12,13 En el caso de nuestra casuística, 28 de 29 pacientes con hidrocefalia aguda fueron de mal grado neurológico. Sin embargo, no encontramos diferencia estadísticamente significativa en RS-m a los 6 meses con el resto de los pacientes sin hidrocefalia aguda.
Limitaciones
Reconocemos las limitaciones dada la naturaleza retrospectiva del diseño del estudio, por lo tanto, sujeto a sesgos. A su vez, la información recolectada representa la experiencia de un único centro. Al ser un centro de derivación, la demora en el traslado y acceso al tratamiento puede condicionar la evolución. Es necesario considerar los factores socioeconómicos de los pacientes y su impacto en la evolución neurológica.
CONCLUSIÓN
Presentamos un análisis de 113 HSA tratadas con clipado aneurismático que requirieron craniectomía descompresiva en las primeras 48 horas. La indicación se asoció al mal grado neurológico, presencia de hidrocefalia, hematoma con efecto de masa y herniación del cerebro en la cirugía. La presencia de hematoma con efecto de masa, el mal grado neurológico y la herniación del cerebro al finalizar el clipado presentaron una asociación estadísticamente significativa con una RS-m desfavorable. El cerebro “relajado”, al finalizar el clipado, puede subestimar el edema cerebral y hay que contextualizarlo con otras variables para tomar una decisión individualizada en cada caso. Este subgrupo de pacientes presentó una alta morbimortalidad. Identificar los candidatos a CD en forma temprana podría cambiar su evolución natural.
Contribuciones de autoría
Conceptualización: Clara Martin. Curación de datos: Sebastián Frascarolli. Análisis formal, Investigación y Redacción - borrador original: Silvina A. Martínez. Metodología: María Guevara. Supervisión: Pablo Rubino. Validación: Flor Montilla. Redacción - revisión y edición: Clara Martin, Pablo Rubino.
BIBLIOGRAFÍA
COMENTARIO
El artículo de Martínez y su equipo es un trabajo sólido que muestra 13 años de experiencia en el manejo de la HSA aneurismática compleja. Proporciona una guía institucional práctica que, si bien es el reflejo de un centro específico, ofrece principios aplicables para la toma de decisiones en otros entornos neuroquirúrgicos.
La alta morbimortalidad asociada a este subgrupo de pacientes enfatiza la urgencia de identificar y tratar agresivamente la hipertensión endocraneana.1,2 Este estudio demuestra que la craniectomía descompresiva, realizada de forma primaria y basada en una evaluación integral de factores clínicos, radiológicos e intraoperatorios, tiene el potencial de modificar el curso clínico de los pacientes con HSA aneurismática de mal pronóstico.3,4
Es un recordatorio de que, en neurocirugía, la experiencia y la observación detallada siguen siendo pilares fundamentales para la mejora continua de la atención al paciente.
Santiago Driollet Laspiur
Servicio de Neurocirugía Funcional, Hospital Nacional “Prof. Alejandro Posadas”, Buenos Aires, Argentina
BIBLIOGRAFÍA