Espasmo hemifacial: análisis de una serie de 42 pacientes tratados con descompresión microvascular
P. Tomas Funes,1 Juan Villalonga,2 Matías Baldoncini,3 Álvaro Campero2,4
1. Servicio de Neurocirugía. Sanatorio Anchorena. Buenos Aires. Argentina
2. Servicio de Neurocirugía. Sanatorio 9 de Julio. Tucumán. Argentina
3. Servicio de Neurocirugía. Hospital de San Fernando. Buenos Aires. Argentina
4. Servicio de Neurocirugía. Hospital Padilla. Tucumán. Argentina
Pedro Tomas Funes
pedrotomasfunes@gmail.com
Recibido: marzo de 2023. Aceptado: marzo de 2023.
DOI: 10.59156/revista.v37i02.506
ORCID:
Pedro Tomas Funes: 0000-0001-9353-7197
Juan Villalonga: 0000-0002-1544-6334
Matías Baldoncini: 0000-0001-9323-8306
Álvaro Campero: 0000-0001-5184-5052
RESUMEN
Introducción. El espasmo hemifacial (EHF) es una condición infrecuente que se caracteriza por la contracción unilateral, paroxística e involuntaria de los músculos de la cara inervados por el nervio facial, causado en la mayoría de los casos por un conflicto vascular en el trayecto cisternal del nervio.
Objetivos. Presentar los resultados de una serie de pacientes a los que se les realizó descompresiva microvascular por EHF.
Pacientes y métodos. Desde junio de 2005 a septiembre de 2022, 42 pacientes con EHF fueron operados; se evaluó edad, género, tiempo de evolución, lado de la afección, realización de toxina botulínica, hallazgos intraoperatorios, resultados postquirúrgicos y complicaciones. Técnica quirúrgica. Se utilizó la posición semisentada y un abordaje suboccipital lateral. En la cisterna, se disecó el flóculo para permitir reclinarlo de abajo hacia arriba y exponer el sitio de origen real del nervio facial. Se colocó teflón interpuesto y el uso de cola de fibrina se ajustó según el caso.
Resultados. El promedio de edad fue 49,6 años, con 61,9% de mujeres. El lado derecho se vio afectado en 20 casos. El vaso mayoritariamente identificado en la cirugía fue la arteria cerebelosa anteroinferior (20 casos). La respuesta fue total en 37 casos, parcial en 3 casos y nula en 2 casos. Déficits transitorios ocurrieron en 9 casos y permanentes en 2 casos.
Conclusión. La mayoría de los pacientes de nuestra serie obtuvieron una mejoría total del espasmo. La descompresiva debe ser considerada como primera línea de tratamiento del EHF primario.
Palabras claves. Descompresiva microvascular. Espasmo hemifacial. Flóculo. Lámina de teflón
Hemifacial spasm: a 42 patients series analysis treated with microvascular decompression
ABSTRACT
Background. Hemifacial spasm is a rare condition characterized by unilateral, paroxysmal, and involuntary contraction of the facial muscles innervated by the facial nerve, caused in most cases by a vascular conflict in the cisternal course of the nerve.
Objectives. To present the results of a series of patients who underwent microvascular decompression by hemifacial spasm.
Methods. From June 2005 to September 2022, 42 patients underwent surgery; age, gender, time of evolution, side of the condition, the performance of botulinum toxin, intraoperative findings, post-surgical results, and complications were evaluated. Surgical technique. The semi-sitting position and a retrosigmoid approach were used. In the cistern, arachnoid dissection of the flocculus was performed to allow reclining it from the bottom to up and expose the exit zone of the facial nerve. Teflon felt was interposed, and the use of fibrin glue was adjusted according to the case.
Results. The average age was 49.6 years, with 61.9% women. The right side was affected in 20 cases. The vessel most frequently identified in surgery was the anterior inferior cerebellar artery (20 cases). The response was total in 37 cases, partial in 3 cases, and null in 2 cases. Transitory deficits occurred in 9 cases and permanent deficits in 2 cases.
Conclusion. Most of the patients in our series obtained a total improvement in the spasm. Decompression should be considered the first line of treatment for primary hemifacial spasms.
Keywords. Flocculus, Hemifacial spasm, Microvascular descompression, Teflon felt.
INTRODUCCIÓN
El espasmo hemifacial (EHF) es una condición infrecuente que se caracteriza por la contracción unilateral, paroxística e involuntaria de los músculos de la cara inervados por el nervio facial. La afectación bilateral ha sido apenas reportada y afecta a menos del 5% de los casos. Se estima una prevalencia de 14,5 mujeres y 7,4 hombres cada 100.000 habitantes,1 afectando a pacientes entre la cuarta y sexta década de la vida. Algunas estadísticas reportadas refieren un aumento discreto de la prevalencia en asiáticos (de causa incierta) y mayor afectación de la hemicara izquierda.2
Desde un punto de vista fisiopatológico, el EHF se clasifica en primario (cuando es producto del conflicto entre una arteria -generalmente la AICA- y el nervio facial) y secundario (cuando es generado por una patología que irrita el núcleo del nervio facial).
La clínica clásica implica un espasmo indoloro que se inicia en el orbicular del ojo del lado afectado con posterior irradiación hacia la cara y boca, incluyendo la frente y el platisma. Existen casos con presentación atípica donde el movimiento involuntario comienza en la región perioral y se irradia a la musculatura periocular. La afectación durante el sueño del EHF suele ser un criterio muy útil para el diagnóstico diferencial con otras afectaciones que tienen una particular asociación con la vigilia y no el descanso. Los casos de EHF secundario por compromiso central (placa desmielinizante, isquemia o hemorragia) suelen presentar activación sincrónica tanto de la región periocular como perioral.3 Es de mención que cerca del 40% de los pacientes con EHF tienen hipertensión arterial.
Se han intentado múltiples asociaciones terapéuticas buscando mejorar las crisis o curarlas: carbamazepina, fenitoína, gabapentina, benzodiazepinas o baclofeno entre una extensa lista de opciones con resultados poco alentadores. La toxina botulínica es aceptada como una alternativa efectiva para reducir los síntomas, con un efecto que no disminuye con la reiteración de las administraciones y un límite de hasta tres administraciones anuales; estrategia tampoco curadora ya que habitualmente el efecto desaparece luego del cuarto mes del procedimiento.3
El único tratamiento efectivo a largo plazo para el EHF es la cirugía de descompresión microvascular (DMV), y es la indicación en pacientes que se encuentran en condiciones clínicas adecuadas para realizarse una neurocirugía.
El objetivo del presente artículo es presentar los resultados de una serie de pacientes a los que se les realizó DMV por espasmo hemifacial.
PACIENTES Y MÉTODO
Pacientes operados
Desde junio de 2005 a septiembre de 2022 en el Hospital “Ángel C. Padilla” y el Sanatorio “9 de Julio” de San Miguel de Tucumán, Argentina, 42 pacientes con diagnóstico de EHF primario fueron operados realizando una DMV. En todos los casos las cirugías fueron realizadas por el último autor (AC). Las historias clínicas y los videos quirúrgicos fueron analizados, evaluando: edad, sexo, tiempo de evolución clínica previo a la cirugía, lado de la afección, realización de toxina botulínica antes de la cirugía, hallazgos intraoperatorios, resultados postquirúrgicos y complicaciones.
Técnica quirúrgica
Posición: el paciente es colocado en posición semisentada, con la cabeza ligeramente flexionada y rotada hacia el lado de la lesión. Es importante dejar al menos 2 través de dedo entre el borde inferior de la mandíbula y el esternón, para que el paciente tenga un apropiado retorno venoso.4
Incisión: se realiza una incisión vertical de aproximadamente 10 cm de longitud, localizada 1 cm medial a la ranura digástrica y centrada con el borde posterior del pabellón auricular.5
Craneotomía: se la realiza de forma redondeada y con aproximadamente 4 cm de diámetro. Es muy importante que queden expuestos 2-3 mm de seno transverso y seno sigmoideo.
Apertura dural: se realiza la misma siguiendo los bordes de los senos transverso y sigmoideo, teniendo una forma de herradura.

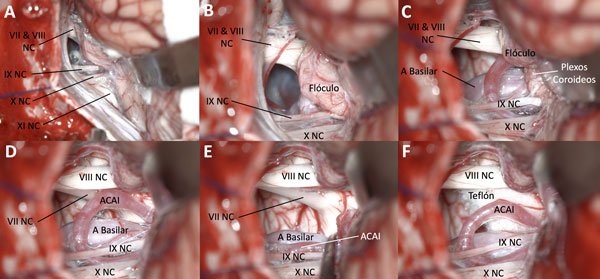
Figura 1. Al ingresar a la cisterna del ángulo pontocerebeloso se observa el flóculo obstruyendo la visión del sitio de salida real del nervio facial (A y B). La disección aracnoidea del floculo desde la cisterna de los pares bajos permite la retracción desde caudal a rostral que limita el estiramiento latero-medial (C y D). Se identifica la arteria cerebelosa anteroinferior; se la reclina y separa del nervio, interponiendo una lámina de teflón (E y F).

Figura 2. En ocasiones, para lograr una efectiva retracción ascendente del flóculo, se requiere disecar el plexo coroideo. El VII par suele estar anatómicamente anterior e inferior en el paquete, por lo que identificarlo desde abajo en el sitio de salida del tronco es la manera correcta de reconocer el conflicto, en este caso originado por la arteria cerebelosa anteroinferior.
Colocación del teflón: una vez identificado el conflicto neurovascular, se coloca el teflón entre la arteria y el nervio, intentando que el mismo quede "enganchado" en el lugar con bridas aracnoideas, para evitar su movimiento posterior. En el caso de que el teflón no quede bien sujetado, se coloca cola de fibrina para sujetarlo. Es importante intentar colocar el teflón entre la arteria y el tronco cerebral y no directamente sobre el nervio; algunas veces no hay otra alternativa que colocarlo sobre el nervio (Figura 3).
Cierre: una vez realizada la hemostasia, se procede al cierre según técnicas estándares.
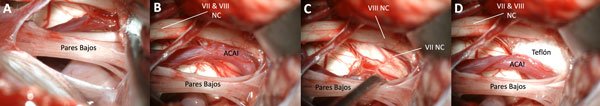
Figura 3. La disección de la arteria cerebelosa anteroinferior debe preservar la microvasculatura del nervio, por lo que es elemental realizar una disección aguda y cuidadosa omitiendo el uso de coagulación.
RESULTADOS
El promedio de edad fue 49,6 años (18-71 años) con 61,9% de mujeres y 38,1% de hombres. La mayor aparición de casos fue en la 5ta década de la vida (16 casos). El tiempo de duración medio de los síntomas fue de 5,4 años (con pacientes que convivieron con la clínica un mínimo de 1 año y un máximo 14 años) (Figura 4). El lado derecho se vio afectado en 20 casos (15 mujeres y 5 hombres); 22 casos involucraron el lado izquierdo (11 mujeres y 11 hombres). De los 42 pacientes, 22 realizaron toxina botulínica previo a la cirugía y 20 no recibieron toxina. Los vasos identificados en la cirugía en el conflicto fueron: arteria cerebelosa anteroinferior (20 casos), arteria cerebelosa posteroinferior (12 casos, Figura 5), arteria vertebral (4 casos), arteria basilar (3 casos), arteria basilar + arteria cerebelosa anteroinferior (2 casos) y arteria vertebral + arteria cerebelosa posteroinferior (1 caso, Figura 6). Luego de la cirugía de descompresión microvascular, la respuesta fue total en 37 casos, parcial en 3 casos y nula en 2 casos. De los casos con respuesta total, la mejoría fue inmediata en 30 casos , 1 caso a las 3 semanas, 3 casos a los 2 meses, 1 caso a los 3 meses, 1 caso a los 6 meses y 1 caso a los 9 meses. Un caso con respuesta parcial se observó a los 2 meses. No hubo complicaciones post quirúrgicas en 30 casos. Déficits transitorios ocurrieron en 9 casos (paresia facial en 6 casos; ataxia 2 casos; hipoacusia en 1 caso; paresia facial + hipoacusia + ataxia en 1 caso). Déficits permanentes ocurrieron en dos casos (hipoacusia en 1 caso; tinnitus en 1 caso). No hubo pacientes con déficits de pares bajos. No se registraron casos de mortalidad (Tabla 1).
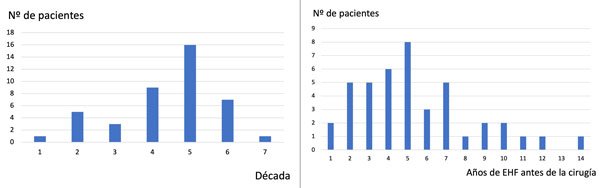
Figura 4. La mayoría de los pacientes estudiados estaban en la 5ª década de la vida y el tiempo de evolución de los síntomas fueron 5,4 años.

Figura 5. El conflicto identificado fue de la arteria cerebelosa posteroinferior.

Figura 6. El conflicto identificado fue de la arteria vertebral y la arteria cerebelosa posteroinferior.
Tabla 1. Espasmo hemifacial y descompresiva microvascular: serie de 42 casos.
| Casos | Edad (años) | Sexo* | Tiempo de duración (años) | Lado** | Botox Previo | Vaso Intraoperatorio | Remisión Postoperatoria*** | Complicaciones**** |
| 1 | 58 | F | 5 | D | SI | Pica | T | No |
| 2 | 34 | M | 3 | D | NO | Aica | T (3 semanas) | No |
| 3 | 55 | M | 4 | D | NO | Aica | T | No |
| 4 | 50 | F | 5 | I | SI | Av | N | VII (T) |
| 5 | 46 | F | 9 | I | SI | Aica | T | Ataxia (T) |
| 6 | 51 | M | 4 | I | NO | Aica | T (2 meses) | No |
| 7 | 58 | M | 7 | I | SI | Pica | T | No |
| 8 | 65 | F | 3 | D | SI | AB | P (2 meses) | VIII (D) |
| 9 | 41 | F | 4 | D | SI | AB | T | No |
| 10 | 69 | F | 5 | D | NO | Aica | T | No |
| 11 | 58 | M | 7 | D | SI | Aica | T | No |
| 12 | 47 | F | 4 | D | NO | AB + Aica | T | VII (T) |
| 13 | 59 | M | 6 | I | NO | Pica | T | No |
| 14 | 37 | F | 2 | I | NO | Aica | T | No |
| 15 | 21 | F | 5 | I | NO | Aica | T | No |
| 16 | 69 | F | 5 | D | SI | Av | T (5 meses) | VIII (T) |
| 17 | 65 | M | 3 | I | SI | Pica | P | Ataxia |
| 18 | 68 | F | 12 | I | SI | AB | T | No |
| 19 | 50 | M | 9 | D | NO | Aica | T | No |
| 20 | 48 | M | 4 | D | SI | Pica | N | No |
| 21 | 45 | F | 2 | D | NO | Aica | T | VII (T) |
| 22 | 51 | F | 7 | D | SI | Aica | T | No |
| 23 | 66 | M | 3 | I | SI | Pica | T (3 meses) | Tinitus (D) |
| 24 | 30 | M | 5 | I | NO | AB + Aica | T (6 meses) | No |
| 25 | 71 | F | 5 | D | NO | Pica | T | No |
| 26 | 62 | F | 4 | I | SI | Pica | T | VII (T) |
| 27 | 29 | M | 6 | I | SI | Aica | T (2 meses) | No |
| 28 | 41 | M | 11 | I | NO | AV | T | No |
| 29 | 54 | F | 2 | D | NO | Aica | T | No |
| 30 | 18 | F | 1 | D | NO | Aica | T | No |
| 31 | 28 | F | 2 | I | NO | Aica | T | No |
| 32 | 55 | F | 8 | I | NO | Pica | T | No |
| 33 | 49 | F | 5 | I | SI | AV + Pica | T | No |
| 34 | 52 | M | 10 | I | SI | Pica | T | VII (T) |
| 35 | 41 | F | 3 | D | SI | Aica | T (9 meses) | No |
| 36 | 43 | F | 10 | D | SI | AV | P | No |
| 37 | 52 | F | 1 | I | NO | Pica | T | No |
| 38 | 59 | F | 14 | D | NO | Aica | T | VII (T), VIII (T), Ataxia (T) |
| 39 | 58 | M | 6 | I | SI | Aica | T | VII (T) |
| 40 | 56 | F | 7 | I | SI | Aica | T | No |
| 41 | 22 | F | 2 | D | NO | Pica | T | No |
| 42 | 55 | M | 7 | I | SI | Aica | T | No |
*(M) Masculino - (F) Femenino
** (D) Derecho - (I) Izquierda
*** (T) Total - (P) Parcial - (N) Nada
**** (T) Transitorio - (D) Definitivas
DISCUSIÓN
Breve reseña histórica
Se reconoce que el primer reporte de EHF lo hizo Schultze en 1875, describiendo un paciente de 56 años con movimientos involuntarios de la mitad izquierda de la cara; más tarde estudios de necropsia revelarían un aneurisma gigante de la arteria vertebral izquierda comprimiendo el 7º par como origen de los síntomas. En 1886 y 1892, Gowers y Brissaud respectivamente describieron las características clínicas del espasmo, asociando el aumento de éste a situaciones de mayor stress y ausencia de mejoría con el descanso y el sueño. El término EHF fue recién incorporado a la comunidad científica en 1905 por Babinsky, sumando el aporte semiológico y descriptivo que el orbicular de los párpados se contrae y el ojo se cierra mientras el músculo frontal se contrae y la ceja se eleva. Esta característica lo diferencia del blefaroespasmo, condición generalmente bilateral donde el párpado se cierra y al no contraerse el músculo frontal, la ceja no se eleva. La mejoría con la DMV fue propuesta por Gardner en 1962 como herramienta de tratamiento de la neuralgia del trigémino, el EHF y la neuralgia del glosofaríngeo. Posteriormente (y por la popularización de la técnica por Jannetta entre 1967 y 1980),6 la cirugía comenzó a desarrollarse y las series empezaron a ser publicadas mostrando notables mejorías a largo plazo.
Epidemiología
El promedio de edad de la serie (49,6 años) coincide con las estadísticas mundiales, que rondan entre 51 y 54 años, siendo la quinta década de la vida el período de mayor aparición del EHF primario, afectando el origen secundario (infartos, placas desmielinizantes, etc.) en general a pacientes menores de 30 años. Si bien el lado derecho no mostró mayor afectación que el izquierdo, el lado derecho tuvo mayor cantidad de casos de sexo femenino, repitiendo los patrones de distribución por género de otras series.7
Etiología y fisiopatología
La etiología más frecuente se centra en un conflicto o compresión vascular del nervio facial (causa primaria), generando irritación del nervio por el latido transmitido por el vaso. La arteria cerebelosa anteroinferior representa la mayoría de los casos. Las arterias cerebelosa posteroinferior, vertebral y basilar también han sido descriptas como eventuales causas de la compresión, siendo en el último caso en general por mega-dólico arterias rígidas (por arterioesclerosis) que suelen convertirse en casos desafiantes al momento de obtener una liberación efectiva del nervio. La fisiopatología del EHF primario se cree que se debe a una injuria en la transición entre la mielina central (originada por oligodendrocitos) y la mielina periférica (originada por células de Schwann), creando parches de desmielinización y activación anómala.8 Entre las causas secundarias, han sido asociadas a traumas, placas desmielinizantes, infartos del tronco cerebral, malformaciones arterio-venosas y aneurismas; también existen reportes de casos luego de una parálisis facial periférica. Los mecanismos fisiopatológicos más aceptados en el EHF secundario proponen que existe una irritación crónica del núcleo del nervio (por ejemplo, en algunos casos de hemiespasmo secundario a isquemias).
En la gran mayoría de los casos de EHF primario, la zona de conflicto se ubica en la zona de salida del nervio facial; por lo tanto, es el lugar donde se debe buscar en primer lugar la zona de compresión.
Tratamiento
Los dos tratamientos globalmente aceptados son la toxina botulínica y la DMV, siendo el primero puramente sintomático y con un corto tiempo de duración, mientras el segundo trata la causa y además ofrece una alta tasa de curación (o años libres de enfermedad). Si bien diversos autores recomiendan optar por la opción quirúrgica luego del fracaso de las opciones médicas y la toxina, el éxito alto reflejado en las series hace considerar la DMV como primera opción en la gran mayoría de los pacientes.
Monitoreo neurofisiológico intraoperatorio
El monitoreo se centra en potenciales evocados auditivos del tronco y el registro electromiográfico del nervio facial.
Los potenciales evocados auditivos del tronco evalúan los cambios observados principalmente en las ondas I y V. El descenso duradero de la amplitud de la onda I es un marcador de isquemia coclear, haciendo evidente algún evento relacionado con la microcirculación de la arteria cerebelosa anteroinferior o la arteria laberíntica. La manipulación vascular de la región puede originar vasoespasmo, por lo que se puede usar unas gotas de papaverina y suspender la retracción por unos minutos hasta normalizar la onda. El aumento de la amplitud de la onda I puede exponer alteraciones en la integridad del nervio vestibular por compresión involuntaria por el material protésico interpuesto. No detectar este tipo de alteración vestibular, puede generar en el post operatorio trastorno en la marcha y vértigo.
El descenso entre el 30-50% de la amplitud de la onda V está relacionada con hipoacusia por afectación coclear y estiramiento. También es una onda que decrece en caso de material protésico interpuesto con efecto de masa compresivo y nocivo para el funcionamiento del nervio.
Por su parte, el electromiograma (EMG) intraoperatorio continuo se enfoca en predecir lesiones por estiramiento, calor o compresión del nervio facial. Dentro de las posibilidades de monitoreo por EMG, el registro de la “respuesta de propagación lateral” es un modo de predecir la correcta descompresión del nervio. Este último registro fue popularizado por Moller y Janetta y define que en un EHF típico o una cirugía con descompresión insuficiente, el estímulo de la rama temporal del nervio facial activa la región del músculo mentoniano y el estímulo de la rama mandibular activa el orbicular del ojo. Si bien Moller sostiene que la desaparición de este tipo de activación -cruzada- o diseminada es un marcador de descompresión satisfactoria, otros autores cuestionan la validez del registro y el verdadero impacto en la evolución del paciente.
Teflón, otros materiales y técnica descompresiva
Se han descripto materiales no reabsorbibles y absorbibles, siendo los primeros los mayormente aceptados. Entre las prótesis no reabsorbibles están el teflón (un polímero similar al polietileno), el poliuretano, el teflón expandido e hilos de seda. Los materiales reabsorbibles son la cola de fibrina, la celulosa y la gelatina (Gelfoam®). La lámina de teflón (politetrafluoroetileno, PTFE) ha sido el material de elección de los cirujanos al momento de plantear una DMV ya sea del trigémino como del nervio facial y la combinación más usada es PTFE y la cola de fibrina. El uso de músculo y fascia autóloga está desaconsejado por la gran respuesta fibroso-inflamatoria local que genera.
Se han descripto dos estrategias de descompresión: la interposición y la transposición. La primera implica interponer entre el nervio y el vaso la pieza protésica elegida; el fracaso de elegir este método puede surgir por la migración de la prótesis, el efecto de masa y compresión de un fragmento muy grande o el desarrollo de adherencias y respuestas inflamatorias con formación de granulomas que hacen recaer al paciente con los síntomas. La transposición es una técnica más compleja considerando el reducido espacio a trabajar; si bien es más efectiva ya que reubica la arteria anulando la compresión sin interponer materiales foráneos, es la opción utilizada en algunos particulares casos donde por ser una arteria larga o rígida, la descompresión clásica es insuficiente. Si bien hay descriptas diversas estrategias que deben ajustarse a cada caso en particular, en muchas ocasiones para lograr una descompresión efectiva, se requiere realizar lazos con suturas y teflón alrededor del vaso para aplicarlos a la duramadre del peñasco y hacer duradera la transposición (Figura 7).
La selección de los autores para el desarrollo de la serie al igual que la mayoría de los especialistas en el mundo, fue el teflón y la cola de fibrina (Figura 8). Las grandes series reportan que las complicaciones al uso de materiales interpuestos están conectadas a una técnica incorrecta más que a la selección del material a usar. Queda esperar el desarrollo de estudios para definir materiales con menor incidencia de adherencias o inflamación “sintomática”.

Figura 7. Se identifica un bucle inferior de la arteria cerebelosa anteroinferior en conflicto con el nervio facial. Para lograr una efectiva descompresión se disecó la arteria y luxó el bucle (transposición). Se interpuso teflón para asegurar el resultado.
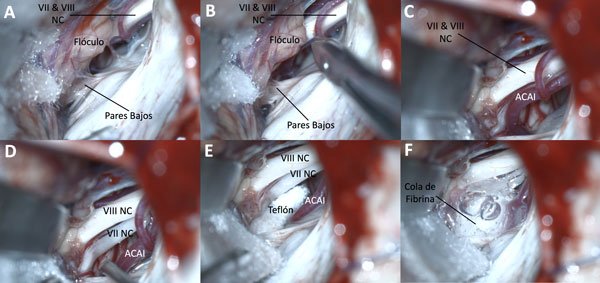
Figura 8. El uso de cola de fibrina es la combinación de elección en la mayoría de las publicaciones y por los autores en particular.
Predictores de respuesta y causas de fracaso
Según diversos autores, el mejor predictor de respuesta a la DMV es la “primer cirugía” (OR 4.16),9 con una evolución libre de síntomas superior al 90% el primer año. Segundos -y sucedáneos- intentos descompresivos suelen tener menor tasa de éxito, explicado por mayor dificultad en la disección de la cisterna y su contenido por adherencias cicatrizales que dificultan la correcta y segura identificación de estructuras. Las causas más frecuentes de fracaso de la cirugía pueden ocurrir por migración de la pieza de teflón usada, adherencias o haber pasado por alto un segundo punto de conflicto más allá del más frecuentemente descripto que es el punto de origen real del nervio facial (Figura 9 y 10). En un metaanálisis de 39 estudios incluyendo 6249 pacientes, la gravedad de la compresión, el uso de toxina botulínica y las características típica o atípica de presentación no tuvieron un rol decisivo en el resultado.9
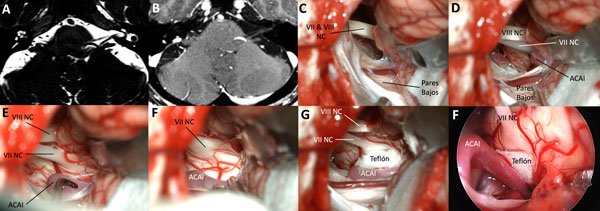
Figura 9. RM con T2 pesado y T1 con gadolinio donde se observa una estructura vascular que impronta desde la región inferior de la salida real del nervio facial en la cisterna del ángulo ponto cerebeloso izquierda (A y B). Luego de disecar y reclinar el flóculo, se orienta el microscopio hacia el tronco cerebral y se observa el origen real del nervio con la impronta vascular referida (C, D, E y F). Se interpone teflón y se corrobora con endoscopio de 30 grados la efectiva descompresión (F).
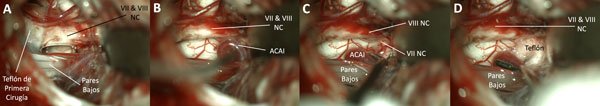
Figura 10. Recirugía: en la primera cirugía (otro equipo), se colocó el teflón muy distal.
Escalas y evolución
Los efectos de la DMV son fácilmente objetivables cuando la mejoría es del 100% y los resultados excelentes. Es más complejo realizar estadísticas y comparar respuestas cuando las mejoras son parciales. Existen escalas e incluso modos de cuantificación de estos casos con respuestas parciales a través de registros electromiográficos, pero ninguna de uso homogéneo por todos los especialistas. Por esa razón, los rangos de lo que se considera un resultado bueno varía entre un 75-90%, siendo un fracaso la mejoría menor del 50%.
Por eso, la utilización de escalas organiza la información y unifica un lenguaje común en beneficio del estudio de los resultados. Entre las escalas más difundidas, la de Shanghai mide calidad de respuesta (excelente, buena, regular y pobre) mientras la escala Japonesa combina eficacia con complicaciones y evaluación de resultados (Tabla 2 y 3). Es de interés la escala de Sindou (Tabla 4), que asociada a un cuestionario de calidad de vida puede dar una acertada idea del resultado de la cirugía teniendo en cuenta la mejoría (total, subtotal, parcial o nula), el nivel de satisfacción del paciente y el grado de discapacidad residual.10 De esta manera, una cirugía efectiva tiene una mejoría total o subtotal con un paciente satisfecho, y una cirugía no efectiva tiene una mejoría parcial o nula y un paciente insatisfecho. En nuestra serie, 3 pacientes tuvieron una respuesta parcial y en 2 pacientes la respuesta fue nula. La respuesta y mejoría total con pacientes satisfechos es de 37 casos (88,1%); las grandes series reportan resultados similares a 10 años.11
Tabla 2. Escala de evolución de Shanghai.
| Escala de evolución de Shanghai | Excelente | Sin síntomas residuales y sin requerimiento de tratamiento médico | Paciente muy satisfecho |
| Buena | Casi sin síntomas, eventuales crisis gatillada por stress o ciertos movimientos faciales | Paciente satisfecho | |
| Regular | Mejoría parcial de los síntomas, todavía frecuentes | Paciente no satisfecho | |
| Mala | Síntomas permanecen sin cambios o incluso peor | Paciente con espasmos invalidantes |
Tabla 3. Escala de evolución Japonesa.
| Escala Japonesa | Eficacia de cirugía (E) | Complicaciones (C) | Evaluación Total (suma puntaje de eficacia y complicaciones) (T) |
| (E-0) Completa desaparición de síntomas | (C-0) No déficits | T-0: Excelente | |
| (E-1) Espasmos suaves esporádicos | (C-1) Ligeros síntomas cerebeolosos o de pares craneales que no resulta molesto | T-1: Buena | |
| (E-2) Espasmos moderados | (C-2) Síntomas cerebelosos y de pares craneales molestos para la vida diaria | T-2: Regular | |
| (E-3) No curado | T-3 a T-5: mala |
Tabla 4. Escala de evolución de Sindou.
| Escala de Sindou | |||
| Grado 0 | Mejoría total | Paciente totalmente satisfecho | |
| Grado 1 | Mejoría subtotal | Paciente con espasmos esporádicos bajo situaciones de stress (no invalidante) | Paciente satisfecho |
| Grado 2 | Mejoría parcial | Alivio de lo síntomas entre un 50-90% (invalidante) | Paciente no satisfecho |
| Grado 3 | Fracaso | No efecto o mejoría menor del 50% | Paciente no satisfecho |
Respecto a la cura diferida o demorada, es interesante repasar algunas definiciones. La mejoría en un mayoritario número de pacientes es total e inmediata. Pero existen casos donde se observa dicha mejoría demorada en semanas o incluso meses desde la cirugía; debido en parte por el tiempo que requiere la re-mielinización de los axones del nervio. Otra teoría sugiere que la demora en la desaparición o disminución de los síntomas tiene que ver con un cuadro de hiperexitabilidad del núcleo motor del nervio facial. Por consenso general, se estima que un año es un tiempo prudencial de espera y posterior a los 12 meses, se puede catalogar al paciente como refractario o sin respuesta al tratamiento quirúrgico. En nuestra serie, 7 casos (16,6%) tuvieron una respuesta diferida (rango de 3 semanas a 9 meses); Sindou reporta con respuesta demorada a un tercio de los pacientes intervenidos (33% ![]() 8). Por lo referido, la recomendación general es no plantear una re-cirugía antes de haber transcurrido 12 meses de tiempo de observación.
8). Por lo referido, la recomendación general es no plantear una re-cirugía antes de haber transcurrido 12 meses de tiempo de observación.
En contraposición, el grupo de Shanghai liderado por Zhong y cols. plantea que la recirugía debe adelantarse incluso a la misma internación, considerándose cuando la mejoría es nula, empeoró o la exploración de todo el recorrido del nervio fue incompleta. El objetivo es evitar la formación de adherencias aracnoideas que puedan dificultar una intervención exitosa diferida.12 Los autores no están de acuerdo con esta posición, considerando que estarían re operándose casos con re-mielinización incompleta o hiper-excitabilidad residual del núcleo del nervio.
Con relación a la recurrencia, algunos autores consideran que es la recaída post cirugía después de un mes libre de síntomas.13 Si bien es una propuesta de definición, no es globalmente aceptada ya que la mejoría podría responder a la natural neuropraxia de la raíz durante las maniobras de manipulación quirúrgica, para luego reaparecer los síntomas a los 30 días, y si la descompresión fue efectiva, volver a desaparecer el espasmo cuando la re-mielinización del nervio facial se completó. Por consenso global, un paciente libre de enfermedad por 2 años está considerado curado, y la recurrencia posterior se estima menor al 1%. En suma, la recirugía debe ser diferida al menos 1 año en aquellos casos con nula respuesta o evidencias de exploración incompleta del trayecto cisternal del nervio (siendo el sitio más insuficientemente explorado el sector de salida en el tronco cerebral).
Complicaciones
Si bien la mortalidad reportada de la DMV es menor del 1% (y cero en nuestra serie), debe prestarse atención a las morbilidades asociadas, como la fístula de líquido céfalo raquídeo o la alteración de pares craneales, por ser las principales intercurrencias post operatorias de las series.
La parálisis facial puede ser inmediata o tardía. La primera suele deberse a la neuropraxia generada por las maniobras de disección, la liberación de calor por coagular estructuras contiguas al nervio o incluso el efecto de masa generado por el teflón interpuesto. Aparece en las primeras 24 horas, afecta a un 2,7-22,5% y es definitiva en menos del 1%. La afectación tardía (o demorada) está descripta entre el día 2 y el 30 posterior a la cirugía y suele deberse a alteraciones en la microcirculación del nervio por probable vasoespasmo o activación viral silente en el ganglio de la raíz activado por el stress quirúrgico. Afecta al 10% de los casos aproximadamente y suele ser transitorio en la mayoría de las veces.10 En nuestra serie la paresia facial fue transitoria y apareció en 7 casos (16,6%).
Alteraciones en la audición aparecen en 1,9-20% de los casos, siendo el déficit definitivo 2,3% (aumentando la aparición en mayores de 70 años).7 En nuestra serie solo 2 pacientes presentaron hipoacusia transitoria (4,76%) y 1 caso definitiva (2,38%). Las causas suelen estar asociadas a la retracción cerebelosa requerida para tener control visual de la salida real del nervio en el tronco, la liberación de calor por coagulación cercana o el efecto compresivo del material interpuesto. Alteraciones en la microcirculación de la arteria laberíntica o la arteria cerebelosa anteroinferior también puede generar injuria coclear e hipoacusia, pero se estima un origen menos frecuente. El tinnitus es menos frecuente, coincidiendo las series reportadas con los hallazgos de nuestros pacientes, con 1 solo caso con dicha intercurrencia (2,38%).
CONCLUSIÓN
La mayoría de los pacientes de nuestra serie obtuvieron una mejoría total de su espasmo. La DMV debe ser considerada como primera línea de tratamiento del EHF primario.
Financiamientos: ninguno para declarar.
Conflicto de intereses: ninguno para declarar.
Este es un artículo de acceso abierto bajo la licencia CC BY-NC https://creativecommons.org/licenses/by-nc/4.0/
BIBLIOGRAFIA
COMENTARIO
Los autores describen con precisión una serie interesante de pacientes portadores de espasmo hemifacial, poniendo especial atención a factores específicos como la edad, el tiempo de evolución de la patología, la respuesta a tratamientos previos al tiempo que detallan con precisión la técnica quirúrgica.
Sólo falta enfatizar el hecho de que la cirugía juega un rol clave en el manejo de esta condición con un alto porcentaje de resultados favorables y pocas complicaciones de una patología que trae aparejada una importante afectación de la calidad de vida.
Pablo Landaburu
Hospital Luisa C. De Gandulfo. Provincia de Buenos Aires, Argentina
COMENTARIO
Los autores presentan una serie de 42 pacientes durante 17 años de descompresión microvascular por espasmo hemifacial. Es una presentación estructurada, con información
actualizada e imágenes intraoperatorias, mostrando el paso a paso quirúrgico; buenos
resultados postoperatorios como así también baja tasa de complicaciones y recidiva que
están a la altura de la literatura internacional.
El espasmo hemifacial causa una importante afectación física y psicológica que impacta
significativamente en la calidad de vida de los pacientes. En general, llevan muchos meses
y años bajo seguimiento neurológico recibiendo carbamazepina u otra droga similar más
la aplicación de toxina botulínica periódica con una duración en el mejoramiento de 3 a 6
meses. Uno se pregunta más de una vez qué será mejor para el paciente, si operar en
forma precoz o esperar la derivación tardía del neurólogo. Intuyo que los pacientes no
manejan una adecuada información acerca de la alta efectividad de la descompresión microvascular.
Finalmente, felicito a los autores por compartir este excelente manuscrito, con una
interesante casuística y buenos resultados globales.
Ruben Mormandi
Fundación para la Lucha contra las Enfermedades Neurológicas de la Infancia,
Ciudad Autónoma de Buenos Aires, Argentina.