
Figura 1: Interpretación de campo visual. Rojo: Fiabilidad; Azul: Mapa colorimétrico y numérico; Verde: Desviación total; Círculo: Defecto poblacional.
Manejo preoperatorio de los adenomas hipofisarios. Lo que un residente de neurocirugía debe conocer
Facundo Bourilhon1, Juan F. Villalonga2,3, Agustín Martínez Font2, José I. Pailler2, Adán A. Romano1, Álvaro Campero2,3
1: Servicio de Neurocirugía, HIGA -San Martin, La Plata, Buenos Aires, Argentina.
2: LINT, Facultad de Medicina, Universidad Nacional de Tucumán, Tucumán, Argentina.
3: Servicio de Neurocirugía, Hospital Padilla, Tucumán, Argentina.
Facundo Bourilhon
facundobourilhon@gmail.com
Financiador o Sponsorship: No.
Conflictos de interés: No.
RESUMEN
Las lesiones selares son una patología con una incidencia de 3,2 a 4 / 100,000 y una prevalencia de 78 a 94 / 100,000. Un 10% son incidentalomas en la población adulta. Se cree que su prevalencia en el orden mundial actualmente va en aumento.
En relación a las manifestaciones clínicas, cabe destacar que es una de las pocas enfermedades que pueden manifestarse tanto por signos y síntomas neurológicos (por ejemplo: hemianopsia bitemporal, síndrome de hipertensión endocraneana debido a hidrocefalia, entre otros), como también por síndromes endocrinológicos (por ejemplo: síndrome de Cushing, acromegalia, amenorrea-galactorrea, infertilidad).
Todo paciente debe presentar un estudio clínico-radiológico completo, lo que permitirá un correcto diagnóstico y categorización del mismo.
El objetivo del presente trabajo es proporcionar al neurocirujano en formación los conceptos claves que servirán de sustento para el manejo preoperatorio de un paciente con adenoma hipofisario.
Palabras claves: PRL: Prolactina; GH: Hormona del Crecimiento; ACTH: Hormona Estimuladora de la Corteza Adrenal; RM: Resonancia Magnética; TC: Tomografía Computada; LCR: Líquido Cefalorraquídeo; CVC: Campo Visual Computarizado
ABSTRACT
Sellar lesions are a pathology with an incidence of 3.2 to 4 / 100.000 and a prevalence of 78 to 94 / 100.000. Normally, 10% of them are incidentalomas and adult patients are in the highest risk group. Because it´s prevalence in the world is currently increasing, it is of extremely importance to study and understand this pathology. In relation to the clinical manifestations, it should be noted that it is one of the few diseases that can manifest through neurological signs and symptoms like bitemporal hemianopsia, endocranial hypertension syndrome due to hydrocephalus, as well as endocrinological syndromes like Cushing's, acromegaly, amenorrhea-galactorrhea and infertility. One of the most important things to notice is that the treatment success in this pathology comes with the correct diagnosis and characterization of it, for what all patients should have a complete clinical-radiological evaluation.
In this study, we establish a guide with concepts and key tools to support the medical personal during a pre-surgical preparation of patients with pituitary adenoma.
Keywords: PRL: prolactin; GH: Growth Hormone; ACTH: Adrenocorticotropic hormone; MR: Magnetic Resonance; CT: Computed Tomography; CSF: Cerebrospinal Fluid; CVC: Visual Computerized Campimetry
INTRODUCCIÓN
Las lesiones selares son una patología con una incidencia de 3,2 a 4 / 100,000 y una prevalencia de 78 a 94 / 100,000. Un 10% son incidentalomas en la población adulta.3,42,46,54,55 Se cree que su prevalencia en el orden mundial actualmente va en aumento.[55,59] El rango histológico es amplio, desde un espectro benigno hasta una enfermedad invasiva difícil de curar en el 0,1 a 0,2.3,42,46
Desde un punto de vista clínico los adenomas pueden ser clasificados en funcionantes y no funcionantes (NF), siendo estos últimos los más frecuentes. Dentro del grupo de los funcionantes el orden de frecuencia es prolactinoma, secretor de somatostatina (GH), adrenocorticotrofina (ACTH) y, en menor medida, las restantes estirpes de células.
En relación con las manifestaciones clínicas, cabe destacar que es una de las pocas enfermedades que pueden manifestarse tanto por signos y síntomas neurológicos (por ejemplo: hemianopsia bitemporal, síndrome de hipertensión endocraneana debido a hidrocefalia, entre otros) como también por síndromes endocrinológicos (por ejemplo: síndrome de Cushing, acromegalia, amenorrea-galactorrea, infertilidad).[]
Una situación especial es la de los adenomas silentes. Estos suelen ser diagnosticados como NF ya que su perfil endocrinológico es normal y, por ende, no presentan clínica alguna, pero su análisis inmunohistoquímico revela su identidad positiva hacia alguna estirpe celular. Su prevalencia puede llegar hasta un 30%.20,61
Todo paciente debe presentar un estudio clínico-radiológico completo, lo que permitirá un correcto diagnóstico y categorización del mismo.
El objetivo del presente trabajo es proporcionar al neurocirujano en formación los conceptos claves que servirán de sustento para el manejo preoperatorio de un paciente con adenoma hipofisario.
1. MANIFESTACIONES CLÍNICAS
Cuando nos enfrentamos a un paciente con un adenoma de hipófisis nos podemos encontrar con diferentes escenarios. El primero de ellos involucra hipersecreción hormonal. Esta puede ser de alguna de las estirpes celulares generando diferentes síndromes: amenorrea – galactorrea, síndrome de Cushing, acromegalia o hipertiroidismo secundario. Estos se deben al aumento de la secreción de (en orden de frecuencia): PRL, ACTH, GH y rara vez TSH.42,51,54,55
El segundo tipo de manifestaciones es la hipofunción glandular debido a compresión y destrucción de la porción no tumoral de la glándula, o bien, directamente del hipotálamo. Es conocida la gran tolerancia glandular a las compresiones crónicas pero cada estirpe celular posee una resiliencia diferente, siendo el eje gonadal el más vulnerable y el de afectación más temprana. Sin embargo, sin importar el tamaño del tumor o el tipo de afectación del tallo pituitario, son infrecuentes las manifestaciones relacionadas con la neurohipófisis (i.e. diabetes insípida). Cabe recordar que el hipopituitarismo es una afectación crónica, pero puede instalarse de forma aguda poniendo en riesgo la vida del paciente en el contexto de una apoplejía pituitaria.
El tercer patrón de manifestación es el relacionado al efecto de masa regional. Este puede estar acompañado de las manifestaciones antes mencionadas conjuntamente con cefalea (debido a la afectación del diafragma selar y estructuras inervadas por la primera rama del trigémino) y la afectación visual debido a la extensión supraselar, una de las manifestaciones más características de estos tumores.
Ya en tumores gigantes se puede observar extensión sobre el piso del tercer ventrículo sea por compresión o por invasión, pudiendo generar hidrocefalia con su respectivo síndrome de hipertensión endocraneana.
Asimismo, sin ser infrecuente en los centros de alto aflujo de pacientes, dependiendo de la agresividad tumoral pueden verse también extensiones a fosa media con afectación de lóbulo temporal con sus respectivas convulsiones o diplopía por afectación de los pares craneales ubicados en la fosa posterior y el seno cavernoso.
Debido al florido espectro de manifestaciones que encontramos (endocrinológico, neurológico, oftalmológico) es de gran importancia el entendimiento multidisciplinario para el screening y la detección temprana de esta patología, ya que esto puede dar mejores resultados para los pacientes.
Adenomas no funcionantes
Los adenomas NF son los más frecuentes y pueden representar hasta el 30% de los diagnosticados. Suelen presentarse en el contexto de un paciente con manifestaciones visuales y cefalea o mediante un estudio realizado por otro motivo (i.e. incidentaloma). Como toda lesión selar deber ser estudiada bioquímicamente y oftalmológicamente.
Se presentan en un 60% a 85% con diferentes grados de hipopituitarismo. La deficiencia más prevalente es la de las gonadotropinas (generando pérdida de la líbido y disfunción sexual), seguida por somatotrofina, tirotrofina y corticotropina.3,17,49 La importancia de estas deficiencias está dada por la necesidad de realizar un correcto reemplazo hormonal para disminuir tanto el riesgo quirúrgico como para mejorar el resultado del tratamiento.3,17,24,47,49
Dentro de los adenomas no funcionantes encontramos los adenomas silentes. Estos son adenomas que presentan una positividad histológica a alguna estirpe celular de la adenohipófisis, pero no presentan evidencia clínica u hormonal de hipersecreción alguna.
Adenomas funcionantes
Se expresan clínicamente mediante la secreción aumentada de una determinada hormona hipofisaria, lo que se evidencia mediante análisis de laboratorio. Este se explica más adelante en el apartado correspondiente.
Prolactinoma: el 90% de las mujeres presentan amenorrea/oligomenorrea e infertilidad y un 80% galactorrea. Esto se debe a que la hiperprolactinemia inhibe la producción de GNRH. Ante una mujer postmenopáusica el diagnóstico suele retrasarse. Otra manifestación es la ganancia de peso. En el hombre los trastornos visuales y de pares craneales son más frecuentes ya que estos no suelen consultar por trastornos en la esfera sexual, ya sea falta de libido, disfunción eréctil o seminal. Por dicho motivo, y porque biológicamente los prolactinomas en hombres suelen ser más agresivos (ver clasificación molecular), el diagnóstico en el hombre se realiza con tumores de mayor tamaño.19,63
Productor de GH: una de las principales manifestaciones clínicas que presenta es el síndrome dismórfico. Este consiste en el agrandamiento de las extremidades: los dedos se engrosan incitando a consultar típicamente porque los anillos le aprietan o el calzado ya no es del tamaño adecuado. Los pómulos se vuelven prominentes, presentan macroglosia, agrandamiento de la nariz y la mandíbula que lleva al prognatismo.18
Otros síntomas suelen ser cefalea, sudoración mal oliente (principalmente nocturna), acroparestesias (síndrome del túnel carpiano), dolor articular y engrosamiento progresivo de la voz, este último debido a la macroglosia antes descripta y a la infiltración de glicosaminoglucanos en las partes blandas.18
Entre los cambios a nivel cutáneo encontraremos casi en el 70% de los pacientes piel sudorosa, oleosa y tumefacta debido a la infiltración por glicosaminoglucanos. También es importante destacar el fenómeno de Raynaud que se presenta hasta en un tercio de ellos.
Recordemos que esta enfermedad tendrá un impacto a nivel sistémico, a destacar: la falta de densidad ósea debido a la alta actividad de remodelación ósea estimulada por la IGF-1, hipertensión arterial a causa de la sobrecarga de volumen generada por el riñón y por disfunción endotelial, hipertrofia miocárdica y apnea del sueño.
Productor de TSH: Las manifestaciones clínicas van a estar dadas por con un cuadro hipertiroideo y efecto de masa regional llevando a cefalea, alteración del campo visual, de las estructuras en los senos cavernosos y en casos extremos hipertensión endocraneana. 6,7,22
Este hipertiroidismo suele mal diagnosticarse como una enfermedad de Graves durante años llevando a una terapia errónea con tiroidectomía y/o yodo. En caso de una co-secreción de GH los síntomas de este hipertiroidismo pueden pasarse por alto frente a los de la acromegalia. [6,7,22]
A diferencia de lo que se ve en el hipertiroidismo primario, en estos casos suelen estar ausentes las afectaciones cardiovasculares como la fibrilación auricular y/o la falla cardíaca. El exoftalmos y el mixedema pretibial también suelen estar ausentes, pero de presentarse el primero suele ser ocasionado por invasión local del tumor sobre la órbita. Otras manifestaciones a evaluar son el hipogonadismo, disminución de la libido, infertilidad y disfunción eréctil que se pueden presentar en el contexto de un panhipopituitarismo o de una lesión co-secretora de PRL. 6,7,22
Apoplejía
La apoplejía hipofisaria es un síndrome clínico, categorizado como un cuadro de emergencia. Se produce debido a una hemorragia o a necrosis de la glándula pituitaria. Este término está reservado a los casos donde se evidencian hallazgos clínicos.9,62
La mayoría de los casos ocurre en pacientes con macroadenomas no funcionantes no reconocidos (incidentalomas) seguidos por prolactinomas.9
Las deficiencias hormonales se producen en un 75% de las apoplejías siendo la más frecuente la de las gonadotropinas, pero clínicamente irrelevantes al momento del evento agudo. En el 50% se producen deficiencias en la esfera de ACTH y TSH que pueden poner en riesgo la vida del paciente.9,52,62 Este riesgo de vida se produce por alteraciones en la presión arterial acompañado de trastornos de la natremia ocasionados por la insuficiente cantidad endógena de corticosteroides, hipotiroidismo secundario y/o alteraciones de la neurohipófisis. El reemplazo activo de las gonadotrofinas no es necesario en el periodo agudo, pero es de capital importancia diagnosticar y tratar la insuficiencia suprarrenal aguda en caso de presentarse.62
Evaluación visual
Los pacientes deben ser sometidos a una evaluación completa neuro-oftalmológica para establecer un estado clínico basal para posteriores seguimientos y toma de conducta. Se realizará una evaluación con examen de confrontación, agudeza visual con tablas optométricas de Snellen o Jaeger, tabla de Ishihara, campo visual computarizado y evaluación de pares craneales oculomotores. La realización de una Tomografía de Coherencia Óptica (OCT) es útil pero no indispensable, dado que no es un factor predictor de mejoría postoperatoria.8,13,49
La magnitud de déficit visual está ligada al tamaño del adenoma y a su relación anatómica. Cuando el tumor comprime anteriormente (i.e. cuando tenemos un quiasma postfijado) son más frecuentes los déficits monoculares, escotomas y alteraciones de los colores verdes y rojo.49 Si comprime posteriormente (i.e. cuando tenemos un quiasma prefijado) puede aparecer la conocida hemianopsia bitemporal.31,35
Interpretación de campimetría visual computada.
Lo primero que debemos saber es que ojo se está evaluando. Siempre se encuentra especificado como OS (ojo siniestro o izquierdo) u OD (ojo derecho). Luego debemos interpretar si esta prueba es fiable o no. Esto se realiza con los denominados índices de fiabilidad: falsos positivos, falsos negativos, y pérdida de fijación. La presencia de >20% falsos positivos o negativos, y/o la pérdida de al menos 3 puntos de fijación es recomendación de repetir la prueba ya que se puede considerar no fiable (Figura 1, apartado rojo).
Una vez que la prueba es fiable se continúa con la interpretación de los dos gráficos inferiores. Vamos a encontrarnos con uno numérico y otro en escala de grises. Este último es el más fácil de interpretar y es útil en el seguimiento del paciente. A cada punto evaluado se le otorga un determinado valor de sensibilidad al que a su vez (a diferencia del mapa numérico) se le otorga un color. Cuanto más sensible, más claro el color asignado. El inconveniente con este gráfico es que se puede pasar por alto la variación en la línea de tiempo, ya que la asignación de colores a veces suele ser muy similar. Por dicho motivo, una vez que hemos visualizado el tipo de defecto y la topografía, se recomienda pasar al mapa numérico donde se puede comparar punto por punto (fig. 1, apartado azul).
Los siguientes gráficos son mapas numéricos diferenciales que comparan el examen del paciente con los valores normalizados para su edad (mapa de desviación total) (fig. 1, apartado verde).
En los últimos mapas se va a ver representada la probabilidad estadística de dicha alteración en la población general. Por ende, si encontramos P<5%, significa que la probabilidad de encontrar dicho defecto es menor al 5% (fig. 1, apartado circular).

Figura 1: Interpretación de campo visual. Rojo: Fiabilidad; Azul: Mapa colorimétrico y numérico; Verde: Desviación total; Círculo: Defecto poblacional.
Nueva Clasificación de la WHO. Implicancia de la misma en la consulta preoperatoria45
Actualmente se propone una nueva clasificación utilizando factores de transcripción con el objetivo de llegar a un diagnóstico más certero y tratar de evidenciar la agresividad de estos tumores. Se clasifican en tres vías principales: 1) adenomas corticotropos silentes determinados por el factor de transcripción pituitario t-box (Tpit). 2) Somatotrofos, lactotropos, tirotropos determinados por factor pituitario 1 (Pit-1-) y 3) Gonadotropos determinado por factor esteroidogénico 1 (SF-1).
Los gonadotropos determinados por SF-1 suelen tener un comportamiento de crecimiento lento, baja invasividad y en un rango etario de adulto mayor.
Los adenomas corticotropos silentes determinados por Tpit suelen darse en mujeres, detectados como macroadenomas con invasión de seno cavernoso. Por lo antes dicho son adenomas más agresivos con menor tasa de éxito de remisión al tratamiento quirúrgico.
Los adenomas silentes derivados de Pit-1 son menos del 10 % y pueden ser tirotropos, lactotropos y somatotropos. Suelen darse en pacientes jóvenes con un Ki-67 elevado y gran invasión, por ende, su tasa de resección y de resecabilidad suele ser más limitada.
Por último, encontramos en menos del 5%, tumores clasificados como Null Cell, en los cuales no se encuentra ninguna diferenciación de estirpe celular, función hormonal o factor de transcripción. Hay datos limitados sobre este subtipo, pero se considera un adenoma agresivo.
Como ya mencionamos, uno de los objetivos de esta clasificación es determinar parámetros para orientar si el adenoma en estudio puede llegar a ser de “alto riesgo”. Dichos parámetros son rápido crecimiento, invasión de estructuras adyacentes, Ki-67 elevado. Estas características de alto riesgo y la clasificación actual con factores de crecimiento son elementos sumamente útiles a la hora de informar al paciente y exponer los comportamientos más probables de cada adenoma.
2. EVALUACIÓN ENDOCRINOLÓGICA
El cirujano debe interpretar la clínica y los estudios endocrinológicos para determinar si nos encontramos frente a un paciente con un adenoma funcionante o no funcionante (NF). Para este objetivo es fundamental el trabajo en equipo con el servicio de endocrinología.
El screening hormonal puede diferir según el centro, pero existe un consenso que debe incluir medición en suero de prolactina (PRL), determinación de cortisol, hormona de crecimiento (GH), factor de crecimiento símil insulina tipo 1 (IGF-1), tirotrofina (TSH), T4, T4 libre, testosterona si es varón, FSH/LH y estradiol si es mujer. 17,25
Es imperativo que las deficiencias hormonales sean detectadas para poder realizar un correcto reemplazo ya que esto impacta directamente en el postoperatorio y en el resultado del paciente.47,51,64
Interpretación de los valores de PRL
Lo primero que debemos tener en claro es que la presencia de hiperprolactinemia no siempre es sinónimo de adenoma secretor de PRL.
Hiperprolactinemia en contexto de prolactinoma. Cuando las mediciones son superiores a 200 mcg/dl son diagnósticas de prolactinoma.32,42
Existen estudios que sostienen que los valores de PRL se asocian al tamaño de la prolactinoma. Además, es sabido que las tasas de remisión se asocian al tamaño de la prolactinoma. Por esto, podemos inferir que los valores de prolactina se asocian de modo indirecto al grado de remisión.17,49,64
Hiperprolactinemia sin prolactinoma. Mediciones superiores a los valores de referencia, pero menores a 200 mcg/dl son interpretadas como un fenómeno de pérdida de inhibición de dopamina (su inhibidor fisiológico) generado por compresión y/o disfunción del tallo pituitario. Siempre debemos tener en cuenta otras causas de hiperprolactinemia como psicofármacos (chlorpromazina, haloperidol, metoclopramida, verapamil, cimetidina) o patologías como hipertiroidismo, cirrosis o enfermedad renal crónica.42
Interpretación de ACTH
El hipercortisolismo es causado en un 60% de las veces por un adenoma de hipófisis. Otras causas son el consumo de corticosteroides exógenos, lesiones ectópicas secretoras de ACTH, depresión, alcoholismo, obesidad, adenoma adrenal (Tabla 1).42,50 Cabe destacar que el diagnóstico de síndrome de Cushing y la exclusión de sus causas es el más difícil de realizar, incluso para endocrinólogos. Por dicho motivo el trabajo interdisciplinario entre ambas especialidades es de vital importancia.
A continuación, se presenta una sistematización en 4 etapas para el diagnóstico de adenoma secretor de ACTH:
1) Primer paso. Diagnosticar el hipercortisolismo mediante dos pruebas. La primera consiste en una medición de cortisol en orina en 24 horas y la segunda es una “prueba de dexametasona” para confirmar definitivamente el hipercortisolismo.[5]
Tips sobre prueba de la dexametasona. Se administra una dosis baja de dexametasona (1- 4 mg) que, de poseer un feedback conservado, inhibirá la secreción de ACTH y, por ende, el próximo cortisol urinario matinal será menor a 5 mcg/dl. De lo contrario, la retroalimentación negativa no estará presente y se confirmará el hipercortisolismo. Algunos autores utilizan un umbral de 1,8 mcg/dl ya que la sensibilidad aumenta a 90%.42,44 Tener en cuenta que la obesidad, alcoholismo y depresión pueden dar falsos positivos.10,17,53
2) Segundo paso. Luego de diagnosticado el hipercortisolismo se debe diferenciar entre causas dependientes e independientes de ACTH. La mayoría de los adenomas secretores y las lesiones que generan secreción ectópica de cortisol son dependientes de ACTH. Interpretando esto, se puede realizar una medición de la misma en suero. Valores suprimidos son típicos de lesiones adrenales primarias (u otra causa independiente de ACTH) (Tabla 1), ya que estas lesiones secretan cortisol sin necesidad de esta última hormona, inclusive se encontrará disminuida debido a la retroalimentación negativa ejercida sobre la hipófisis e hipotálamo. Mientras tanto, en los adenomas y en las lesiones ectópicas encontraremos mediciones de ACTH normales o superiores a los valores de referencia.5
3) Tercer paso. Una vez definido que es dependiente de ACTH queda descartar una lesión ectópica secretora de ACTH. Los adenomas, en la mayoría de los casos, conservan su capacidad de autorregulación a los corticoides pero este umbral puede estar aumentado. Este mismo es el fundamento de una prueba de supresión a altas dosis de dexametasona. El test clásico consistía en la administración de dosis bajas pero continuas durante 48 horas para luego evaluar el cortisol urinario. Actualmente, se administra 8 mg por la noche y luego se mide el cortisol plasmático. Una reducción del 50% se considera respuesta positiva. Algunos adenomas suprimen a dosis altas como 32 mg.5,10,17
4) Cuarto paso. Cateterismo de senos petrosos inferiores. La utilización del cateterismo de senos petroso inferiores se ha implementado para el diagnóstico en el contexto de un paciente con un síndrome ACTH dependiente en donde la imagen de hipófisis es negativa. En el 50% de los pacientes con síndrome de Cushing la RM puede ser negativa, por lo cual se debería contemplar la posibilidad de cateterismo de los senos petrosos.10,27,50
Es un estudio de interés tanto para los endocrinólogos como los neurocirujanos. Los primeros buscarán realizar el diagnóstico preciso de la enfermedad y los últimos definir la lateralidad de la lesión. Actualmente se reconoce que la eficacia de este procedimiento es variable y su interpretación no es lineal ya que presenta tasas de sensibilidad de 54 al 96% en el caso de la medición de ACTH central/periférico (índice) y del 81 al 100% en la medición de CRH. No todos los centros con disponibilidad angiográfica poseen los reactivos para realizar esta última.27
Se conoce actualmente que el problema de los falsos negativos se puede dar debido a variantes anatómicas. Hay 6 tipos de drenajes del seno petroso inferior, los cuales pueden modificar el pasaje de sangre a la vena yugular interna. Estas variantes explicarían la mayoría de los falsos negativos. Otra causa es la variabilidad de secreción tumoral.40,48 Por otro lado, el cateterismo de seno cavernoso no ha podido aportar mejoras a estas dudas.36
Debido a la diferencia en prevalencia entre un adenoma secretor de ACTH y una lesión ectópica, que es de 5 a 1, ante un cateterismo negativo sigue siendo probable que ese resultado haya sido un falso negativo, más aún si se suma la negatividad de lesión extra pituitaria capaz de secretar ACTH.27
La utilización de esta técnica sigue siendo un método invasivo y no está exenta de complicaciones: desde otalgia y tinnitus en un 2% hasta complicaciones infrecuentes pero más severas como parálisis de nervios craneanos, hematoma subdurales, infartos de tronco encefálico, o tromboembolismo pulmonar.56
Han existido múltiples estrategias a la hora de emplear esta técnica: por ejemplo, aplicación a cualquier paciente con síndrome de Cushing ACTH dependiente, solo a síndrome de Cushing ACTH dependiente con pruebas dinámicas equivocas, o solo a pacientes con neuroimagen negativa a pesar del diagnóstico endocrinológico exacto.27
Tabla 1: Diagnósticos diferenciales de Adenoma Secretor de ACTH.
ACTH DEPENDIENTE |
ADENOMA PITUITARIO |
ACTH INDEPENDIENTE |
ADENOMA ADRENAL |
PSEUDO CUSHING |
DEPRESIÓN |
Interpretación de GH e IGF-1
La hipersecreción de GH es secundaria la mayoría de las veces (95%) a un adenoma secretor de GH. El 5% restante es secundario a una lesión hipotalámica o neuroendócrina.16,18,33,55
Ante la sospecha de acromegalia se suele realizar la medición de IGF-1 y GH. Existen situaciones en la que estas dos mediciones no son concluyentes y se necesitan pruebas dinámicas. Una de éstas es el test de supresión de GH post administración de 75 gramos de glucosa oral (PTOG).16,18,33
Tips sobre PTOG. La ingesta de la solución glucosada debe realizarse de 10 a 15 minutos para luego determinar GH en tiempo basal y cada 30 minutos durante 2 horas. En condiciones normales los valores serían indetectables debido a la supresión normal. En la mayoría de los pacientes con acromegalia esta supresión no será tal (Tabla 2).14,16,18,33
Tabla 2: Indicación del test de PTOG.18,21,33,37
escenario |
sospecha clínica |
GH |
IGF 1 |
razonamiento inicial |
¿se justifica usar test supresión? |
I |
Baja |
Elevada para la edad |
Dentro VN |
Se descarta acromegalia |
NO |
II |
Moderada |
Elevada para la edad |
Superior VN |
Diagnóstico probable |
SI |
III |
Alta |
Elevada para la edad |
Superior VN |
Diagnóstico de acromegalia |
NO |
Consideraciones a la hora de interpretar resultados.
Debemos considerar que existen determinados contextos tantos patológicos (diabetes mellitus, insuficiencia renal crónica, obesidad, esteatosis hepática) como fisiológicos (embarazo, pubertad) donde los resultados deben ser interpretados con cautela.16,18,26,33
Además, siempre debemos tener presente que los valores de referencia varían según el laboratorio. Si a esto le sumamos que no todos los pacientes acuden al mismo laboratorio, esto constituye un problema a la hora de querer comparar resultados bioquímicos durante el seguimiento. Una posible solución es registrar para el seguimiento un cociente GH/IGF-1.26
Interpretación de TSH
Los tirotropinomas corresponden a menos del 1,5 % y es el menos común de los adenomas funcionantes.2,43 La clave para el diagnóstico hormonal es la elevación o el mantenimiento de TSH en contexto de un paciente con clínica de hipertiroidismo y hormonas tiroideas elevadas (T3, T4). El diagnóstico es siempre por descarte debido a su baja frecuencia y a la cantidad de situaciones que pueden confundir el diagnóstico del mismo, por ejemplo tiroiditis aguda, hipotiroidismo inconsistentemente tratado, anfetaminas, amiodarona, medios de contraste, resistencia periférica a hormonas tiroideas.2,5,43
No se debe dudar de la participación del endocrinólogo en el mismo, ya que hasta un 30% son tratados durante años como un hipertiroidismo primario.2,43
3. EVALUACIÓN IMAGENOLÓGICA
Resonancia magnética
El método gold standard para el diagnóstico imagenológico de un adenoma de hipófisis es la RM. Ese estudio nos servirá también para planificar el abordaje, clasificar el tumor, objetivar estructuras aledañas, predecir resultados postoperatorios y riesgo de complicaciones.11,30,34,41
En relación a los microadenomas, en ocasiones pueden ser dificultosos de hallar en un estudio de baja calidad o sin secuencias dinámicas. Inclusive del 20 al 50% de los adenomas secretores de ACTH pueden no ser visibles en estudios.27 En este sentido, las secuencias dinámicas ayudan a esclarecer la ubicación del tumor.
Clasificación según tamaño
Una clasificación clásica de los adenomas es según su tamaño. Se los clasifica en microadenoma <10 mm (fig. 2), macroadenoma >10 mm (fig. 3), y adenoma gigante > 30 mm (fig. 4). Esta clasificación es importante ya que los índices de remisión están ligados al tamaño del adenoma y también su recidiva.12
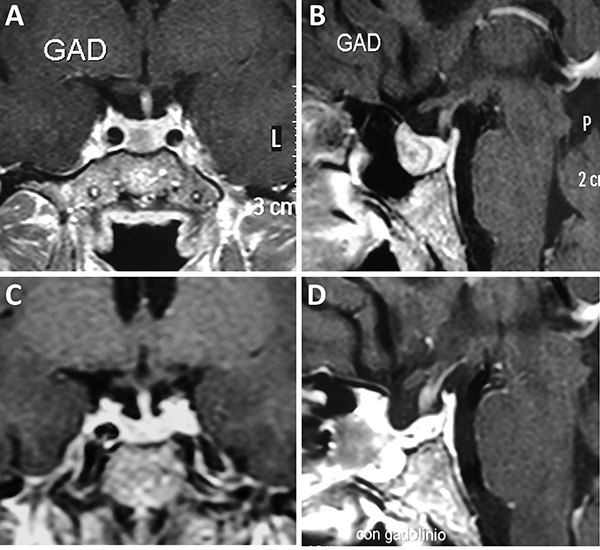
Figura 2: Microadenoma. A-B: RM preoperatoria; C-D: RM postoperatoria.
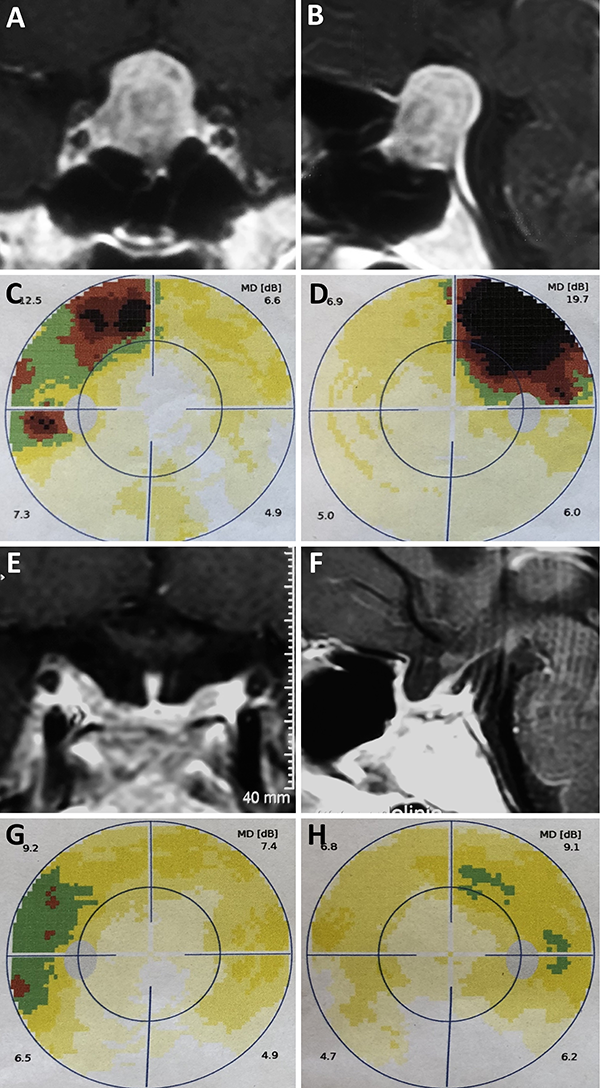
Figura 3: Macroadenoma. A-B: RM preoperatoria; C-D: Campo visual preoperatorio; E-F: RM postoperatoria; G-H: Campo visual postoperatorio.
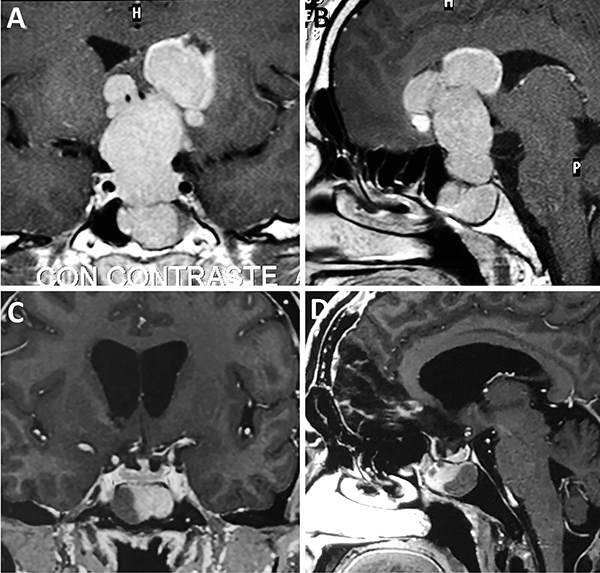
Figura 4: Adenoma gigante. A-B: RM preoperatoria; C-D: RM postoperatoria.
Clasificación de Knosp
En 1992 Knosp et al. publicó una clasificación para cuantificar la invasión del seno cavernoso (Tabla 3). Esta clasificación evalúa la extensión paraselar tomando como referencia la arteria carótida del lado a evaluar. Se elige un corte coronal de RM donde se visualiza la porción supracavernosa e intracavernosa, se traza una línea intercarotídea y se categoriza al paciente según el grado de invasión del adenoma del grado 0 al 4 (fig. 5).34
Tabla 3: Clasificación de Knosp. Tomado de Knosp E, Steiner E, Kitz K, Matula C. 610 Pituitary adenomas with invasion of the cavernous sinus space: a magnetic resonance imaging classification compared with surgical findings clinical study. Neurosurg.1992;33(4):610-618.
Grados |
Descripción |
|
GRADO 0: Se encuentra respetado el seno cavernoso. El tumor no supera la línea tangencial entre la carótida supracavernosa e intracavernosa. |
|
GRADO 1: Tumor no supera la línea tangencial que atraviesa centralmente ambas porciones de la carótida. Línea denominada intercarotídea. |
|
GRADO 2: Se caracteriza por que el tumor se extiende más allá de la línea intercarotídea pero no más allá de una tangencial por la pared lateral de la carótida. |
|
GRADO 3. Se caracteriza por extenderse más allá de la tangencial que cursa la pared externa de ambas porciones de la carótida. |
|
GRADO 4: Englobamiento total de la carótida, sin realce a la administración de contraste por parte del seno cavernoso. |
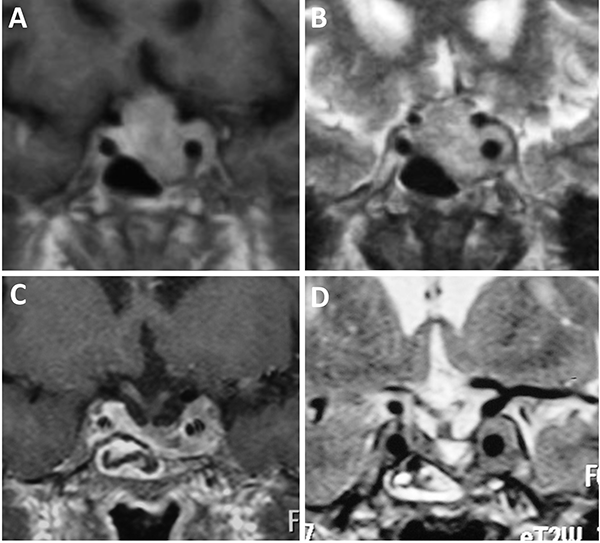
Figura 5: Adenomas hipofisarios Knosp grado 4. A-D: Obsérvese el englobamiento carotídeo.
Clasificación de extensión supraselar
En 1990 el equipo de Canadá publicó una clasificación, actualmente conocida como “de Hardy” en honor a uno de sus mentores (Tabla 4). La misma busca evaluar la extensión supraselar del adenoma. Fue ideada para macroadenomas.30,41
Tabla 4: Clasificación de extensión supraselar.
Grados Hardy |
Extensión |
A |
0–10 mm extensión supraselar ocupando cisterna supraselar |
B |
10–20 mm extensión con elevación del piso del tercer ventrículo. |
C |
20–30 mm de extensión ocupando el receso anterior del tercer ventrículo. |
D |
30 mm extensión más allá de los forámenes de Monro. |
Barrera selar
El techo de la fosa pituitaria está constituido en condiciones normales por un máximo de 2 estructuras: duramadre (diafragma selar) y aracnoides.65,66 En condiciones patológicas, cuando existe un adenoma hipofisario, éste empuja hacia arriba a la glándula. De este modo, la interfase entre el tumor y el LCR se encuentra constituida por un máximo de 3 elementos: glándula, duramadre y aracnoides. Cabe destacar que la aracnoides es el único elemento constante. A los elementos que constituyen esta interfase el equipo de Tucumán los denominó “barrera selar”.11,60
Existen 3 subtipos de barrera selar según los hallazgos intraoperatorios, luego de resecar el tumor:
Un factor interesante de este novedoso concepto es que el tipo de barrera puede evidenciarse en la RM preoperatoria. De este modo, existen 3 subtipos de barrera selar según la radiología:
Los pacientes con una barrera débil tienen mayor riesgo de fístula intraoperatoria de LCR. La barrera fuerte es un factor protector de fístula de LCR.11,60
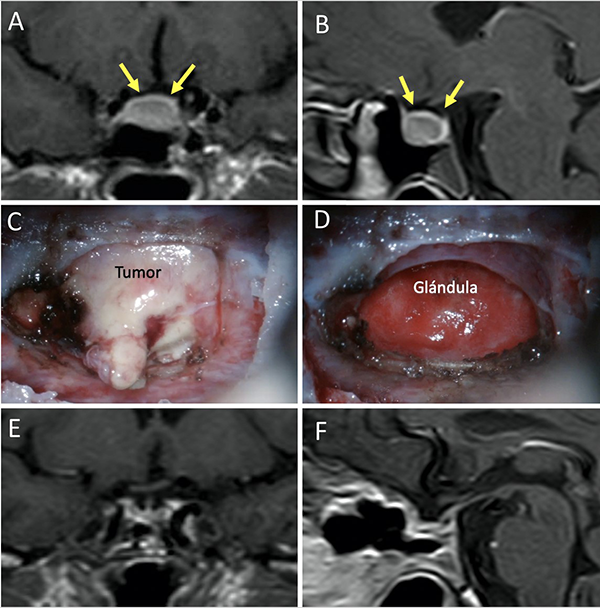
Figura 6: Barrera selar fuerte. A-B) RM preoperatoria. C-D) Hallazgos intraquirúrgicos. E-F) RM postoperatoria. Flechas amarillas: interlinea > 1mm. Tomado de Campero A, Villalonga JF, Basso A. Anatomical risk factors for intraoperative cerebrospinal fluid leaks during transsphenoidal surgery for pituitary adenomas. World Neurosurg. 2019;124:346-55.
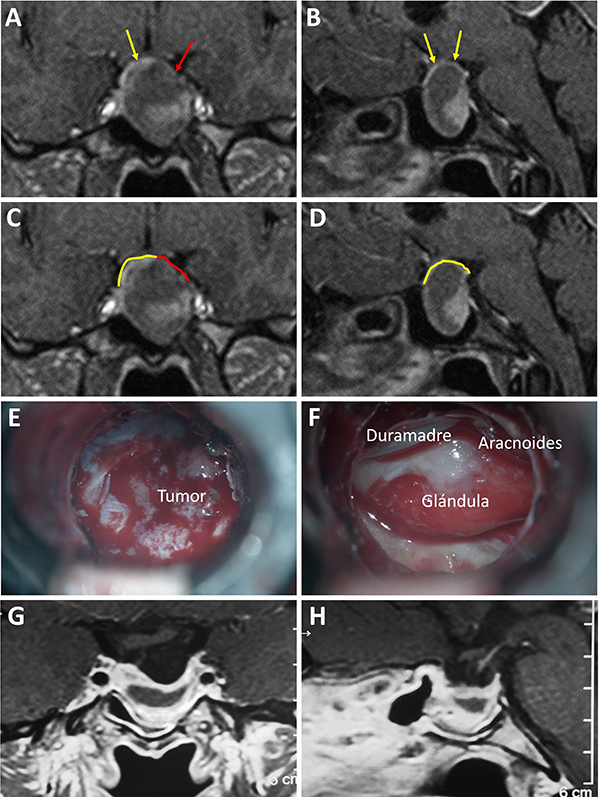
Figura 7: Barrera selar mixta. A y C) RM preoperatoria corte coronal; B y D) RM preoperatoria corte sagital; E-F) Hallazgos intraoperatorios; G-H) RM postoperatoria. Flechas y líneas: color rojo indican barrera débil; color amarillo indican barrera fuerte. Tomado deVillalonga JF, Ries-Centeno T, Sáenz A, Solari D, Cervio A, Campero A. The mixed sellar barrier: a new subtype of this novel concept. World Neurosurg. 2019;132:5-13.
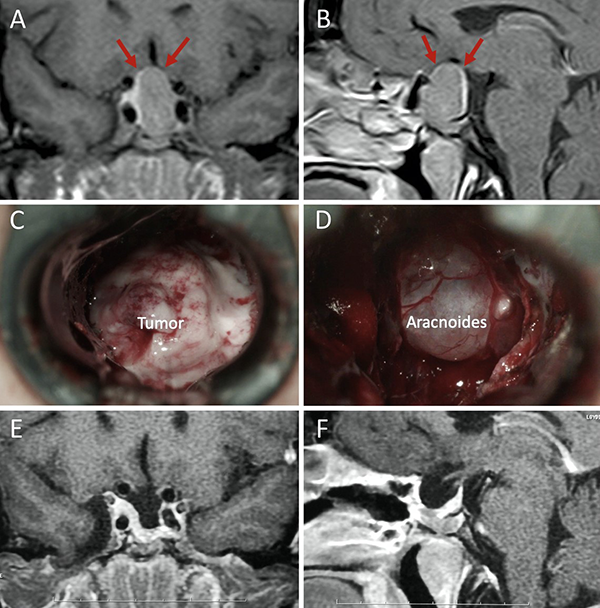
Figura 8: Barrera selar débil. A-B) RM preoperatoria; C-D) Hallazgos intraoperatorios. E-F) RM postoperatoria. Flechas rojas: interlínea < 1mm. Tomado de Campero A, Villalonga JF, Basso A. Anatomical risk factors for intraoperative cerebrospinal fluid leaks during transsphenoidal surgery for pituitary adenomas. World Neurosurg. 2019;124:346-55.
Tomografía computada
La principal utilización de la tomografía es la identificación de estructuras anatómicas óseas útiles a la hora de la planificación quirúrgica. Con una tomografía con reconstrucción 2D se pueden evidenciar con sencillas mediciones las siguientes características: septum nasal, variantes turbinales, presencia y posición de los ostiums esfenoidales, rostrum esfenoidal y su relación con el vómer, neumatización del seno esfenoidal, tabiques intrasinusales, distancia intercarotídea, grado de neumatización de etmoides posterior e identificación de nervios ópticos en su trayecto adyacente al seno esfenoidal.23,29
La evaluación del septum nasal podrá mostrar si presenta desviación o prominencias óseas que puedan dificultar el abordaje como también el tallado de un colgajo nasoseptal del lado elegido (fig. 9).[28] En caso de desvío septal se puede realizar septoplastia selectiva de la región desviada para logar un abordaje adecuado .
En referencia a las variantes turbinales se debe considerar la presencia de hipertrofia turbinal inferior y de cornetes medios bullosos (fig. 10). Ante la hipertrofia turbinal inferior será necesario realizar buena vasoconstricción preoperatoria asociada a luxofractura y lateralización para lograr un abordaje adecuado si es que no se asocia un tratamiento para la insuficiencia ventilatoria. Los cornetes medios bullosos representan una variante hipertrófica con neumatización de los mismos, los cuales podrán resecarse parcial o totalmente para lograr el correcto abordaje.
Respecto a los ostium esfenoidales, cabe destacar que son el punto de entrada óptimo al seno esfenoidal. En caso de ser dificultosa su localización (situación frecuente) se podría ingresar al seno esfenoidal aproximadamente 1,5 cm por encima del borde superior de la coana (fig. 11).23,13
El grado neumatización del seno esfenoidal se puede clasificar en selar, pre selar y conchal (fig. 12).1,29,30,58 En el tipo conchal, el área bajo la silla turca es de hueso sólido sin neumatización. En el tipo preselar, el área neumatizada no penetra más allá del plano perpendicular de la pared selar. En el tipo selar, presente en el 86% de los individuos, la región neumatizada se extiende al cuerpo del esfenoides bajo la silla turca, pudiendo extenderse hacia posterior. Esta característica del seno es importante ya que ante la presencia de un tipo conchal es recomendable la utilización de neuronavegación.23,58
Al observar el seno esfenoidal debemos tener en cuenta la presencia de tabiques internos. Estos no deben ser tomados como referencia de línea media por su variabilidad. En este sentido, un dato cardinal es que un 90% los mismos se dirigen a las carótidas (fig. 13).1,15,23
La distancia intercarotidea determina el campo quirúrgico; a menor distancia es menor el campo y mayor el riesgo de lesión iatrogénica vascular. Otro punto a tener en cuenta es la presencia o no de cobertura ósea de la misma. En algunas oportunidades se va a encontrar recubierta por una lámina de hueso y, en otras, desprovista de la misma (fig. 13).15,23
La identificación de ambos nervios ópticos en la tomografía toma relevancia por una potencial lesión iatrogénica. Se debe identificar a los mismos y valorar su trayecto principalmente cuando el seno esfenoidal y/o etmoides posterior presentan gran neumatización. Éstos pueden estar completamente cubiertos por hueso o presentarse dehiscentes (fig. 14).
El grado de neumatización de etmoides posterior es variable. Se debe identificar si existe hiperneumatización del mismo, con extensión de celdillas a región superior y lateral se seno esfenoidal, variante que conocemos como celdas de Onodi. Su relevancia radica en mantener durante el intraoperatorio un adecuado corredor hacia la hipófisis, y evitar una “falsa vía”, con potencial lesión intracraneal (fig. 15).
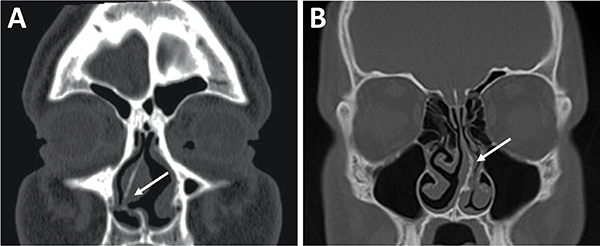
Figura 9: Desvío septal severo en TC cortes coronales. A) Inferior a fosa nasal derecha; B) Medio a fosa nasal izquierda.
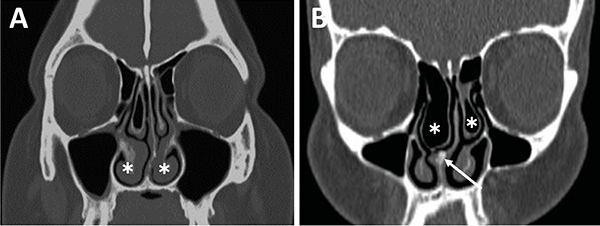
Figura 10: Variantes turbinales en TC cortes coronales. A) Hipertrofia turbinal inferior (asteriscos blancos); B) Cornetes medios bullosos (asteriscos blancos) y desvío septal-espolón (flecha blanca).
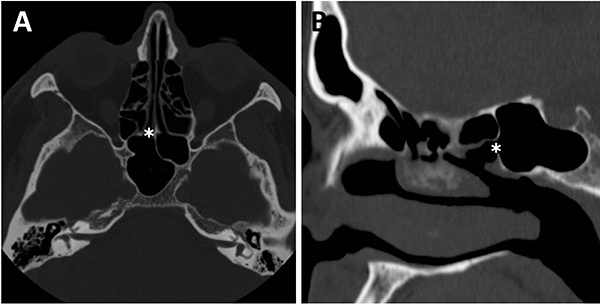
Figura 11: Ostium esfenoidales identificables en TC. A) TC corte axial; B) TC corte sagital.
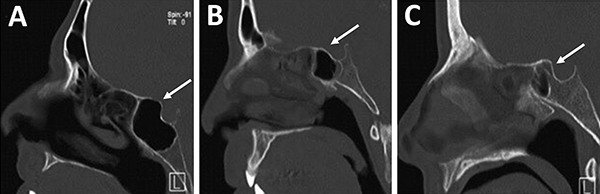
Figura 12: Neumatización del seno esfenoidal en TC cortes sagitales. A) Tipo selar; B) Tipo preselar; C) Tipo conchal.
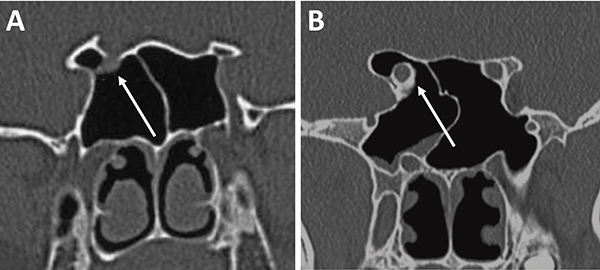
Figura 13: Relación carótida – septaciones esfenoidales en TC cortes axiales. A) Septum interesfenoidal se inserta sobre meso carotídeo izquierdo (flecha blanca); B) Septaciones incompletas que se insertan sobre meso carotídeo en ambos senos esfenoidales (flechas blancas).
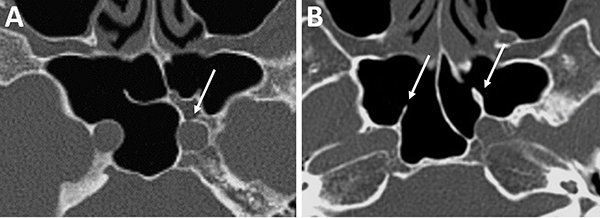
Figura 14: Localización de nervio óptico en TC cortes coronales. A) Nervio óptico dehiscente; B) Nervio óptico en su meso, con variante hiperneumatizada esfenoidal.
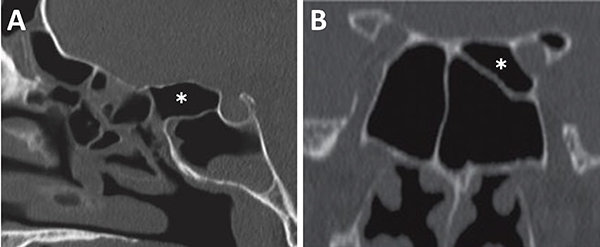
Figura 15: Hiperneumatización de etmoides posterior. A) TC corte sagital; B) TC corte coronal, obsérvese la celdilla de Onodi (asterisco blanco).
4. INDICACIÓN QUIRÚRGICA
La Tabla 5 presenta un algoritmo que resume la indicación quirúrgica de los adenomas hipofisarios (Tabla 3).
Adenomas no funcionantes
El objetivo es la exéresis completa del tumor. De no ser posible, una descompresión tumoral que permita mejorar la calidad de vida, recuperar la función visual, restaurar la función pituitaria y mejorar los resultados de tratamientos adyuvantes.3,4,17,25,49,61
Las indicaciones quirúrgicas se detallan en la Tabla 3.
Tabla 5: Indicaciones quirúrgicas de los adenomas no funcionantes.
Paciente asintomático con macroadenoma |
Alteraciones visuales. Estas alteraciones suelen mejorar en un 80 a 90% de los casos. |
Hipopituitarismo. Debe ser tomado en cuenta para las indicaciones del tratamiento debido a que un 30 % mejoran su condición hormonal. |
Efecto de masa. Cefalea que altera su calidad de vida. En este caso particular el paciente debe ser advertido que no hay garantía de alivio absoluto. |
Situaciones especiales |
Pacientes de edad elevada (>65 años) y jóvenes con un elevado riesgo anestésico. La indicación más importante es la afectación visual. |
Pacientes con consumo de antiplaquetarios e anticoagulantes. La suspensión de los mismos debe realizarse entre 5 a 7 días antes de la intervención. En el caso de estos últimos se espera la normalización del RIN y se puede adicionar vitamina K. |
Embarazo. La indicación mandatoria es la alteración visual. De estar ausente se observará hasta pasado el período gestacional. Este tumor no contraindica el parto vaginal ni la lactancia. |
Adenomas funcionantes
Prolactinomas
Quien se introduce en la cirugía pituitaria debe tener presente que la primera línea de tratamiento de las prolactinomas, actualmente, es farmacológica.3,19,25,42,54,55 Sin embargo, una gran cantidad de pacientes requieren finalmente tratamiento quirúrgico por múltiples motivos entre los cuales podemos destacar: intolerancia a drogas, efectos adversos, falta de adhesión, resistencia, voluntad de someterse a cirugía, contexto socio-económico desfavorable para mantener el tratamiento, entre otros.
Enfermedad de Cushing
Una vez que el paciente haya sido diagnosticado con un adenoma secretor de ACTH, el tratamiento de primera línea es quirúrgico.38,42,55
El mencionado diagnóstico es de capital importancia para la prevención de insuficiencia adrenal mediante el tratamiento sustitutivo con dosis de estrés de corticoides durante el intra y post operatorio.
Acromegalia
La primera línea de tratamiento indiscutida es la quirúrgica.25,26,33,39,64 La acromegalia sin tratamiento aumenta la morbimortalidad del paciente ya que, como hemos explayado anteriormente, es una enfermedad sistémica que repercute en la totalidad del organismo. Sumado a la demora en el diagnóstico, hace que la afectación cardíaca y pulmonar, conjuntamente con las demás nombradas, disminuyan la expectativa y calidad de vida del paciente. La técnica endoscópica ha demostrado lograr mejores tasas de remisión para tratar los adenomas productores de GH tipo Knosp 3 y 4.17,18,26,33,39,57,64
Tirotropinoma
La primera línea de tratamiento es la cirugía para luego continuar con tratamiento adyuvante, si es necesario, ya que las diferentes series llegan solo a un 40% de remisión de la enfermedad.2,43
Apoplejía
La conducta a seguir en la apoplejía pituitaria es controversial ya que no hay estudios comparativos sobre manejo conservador o quirúrgico (fig. 16). Actualmente se reconoce que el primer paso es el control hemodinámico, control electrolítico y administración con corticoides. Luego de este paso inicial, la cirugía es de elección si se reconoce que el paciente posee alteración de la conciencia que no revierte con corticoides o alteraciones visuales.62 Diferentes estudios demuestran mejores resultados en el compromiso tanto de la agudeza visual como en la motilidad extrínseca del ojo con el tratamiento quirúrgico hasta en un 60% de los casos. Otro punto importante es la recuperación de la función glandular, para la cual, la cirugía posee mejores resultados recuperando la función parcial o completamente hasta en un 60%.52,62 Otro argumento fuerte a favor de la cirugía es la posibilidad no solo de mejorar la función visual y glandular sino de generar la exéresis tumoral en el mismo acto. Se ha evidenciado una recidiva tumoral del 11% a 6 años.9
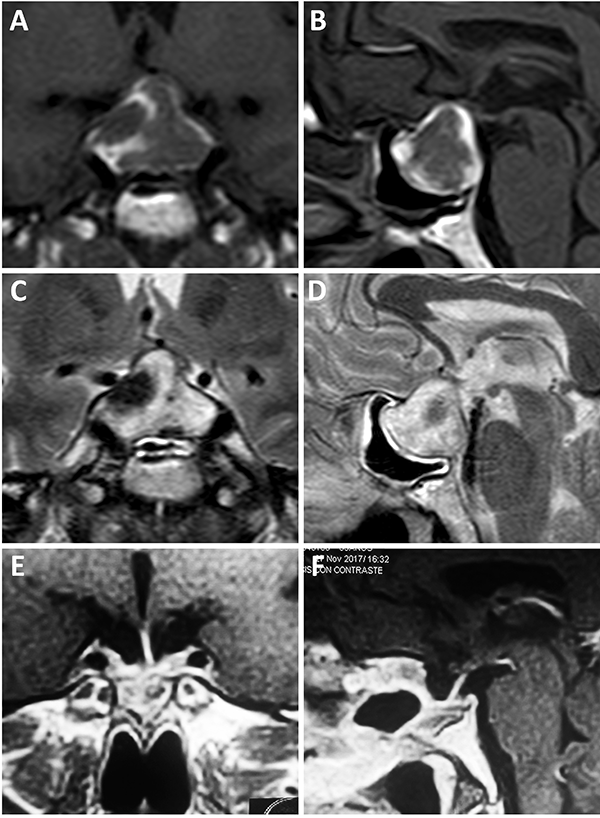
Figura 16: Apoplejía con resolución quirúrgica. A-B) RM preoperatoria, secuencia T1 con contraste; C-D) RM preoperatoria, secuencia T2; E-F) RM postoperatoria, secuencia T1 con contraste.
BIBLIOGRAFÍA
1. Rhoton, AL. The sellar region. Neurosurgery. 2002;51:63-76.
2. Amlashi FG, Tritos NA. Thyrotropin-secreting pituitary adenomas: epidemiology, diagnosis, and management. Endocrine. 2016;52(3):427-40.
3. Andela CD, Lobatto DJ, Pereira AM, van Furth WR, Biermasz NR. How non-functioning pituitary adenomas can affect health-related quality of life: a conceptual model and literature review. Pituitary. 2018;21(2):208-16.
4. Asa SL, Ezzat S. The pathogenesis of pituitary tumors. Annu. Rev. Pathol. Mech. Dis. 2009;4(1):97-126.
5. Ball J, Hurlbert RJ, Winn HR. Pituitary tumors: Functioning and nonfunctioning. In: Winn HR, ed. Youmans neurological surgery 6th ed. Elsevier; 2011, pp 1476-522.
6. Beck-Peccoz P, Lania A, Beckers A, Chatterjee K, Wemeau J-L. 2013 European thyroid association guidelines for the diagnosis and treatment of thyrotropin-secreting pituitary tumors. Eur. Thyroid J. 2013;2(2):76-82.
7. Beck-Peccoz P, Persani L, Mannavola D, Campi I. TSH-secreting adenomas. Best Pract. Res. Clin. Endocrinol. Metab. 2009;23(5):597-606.
8. Beltrame S, Rasmussen J, Plou P, Altszul M, Yampolsky C, Ajler P. Optical coherence tomography as a predictor of visual recovery in patients with pituitary macroadenomas. Surg. Neurol. Int. 2018;9(3):S57-65.
9. Briet C, Salenave S, Bonneville J, Laws ER, Chanson P. Pituitary Apoplexy. 2015;36(December):622-45.
10. Buliman A, Tataranu LG, Paun DL, Mirica A, Dumitrache C. Cushing’s disease: a multidisciplinary overview of the clinical features, diagnosis, and treatment. J. Med. Life. 2016;9(1):12-8.
11. Campero A, Villalonga JF, Basso A. Anatomical risk factors for intraoperative cerebrospinal fluid leaks during transsphenoidal surgery for pituitary adenomas. World Neurosurg. 2019;124:e346-55.
12. Campero A. Macroadenomas de hipófisis con extensión supraselar: resultados quirúrgicos en 30 casos operados por vía endonasal transesfenoidal. J. Bras. Neurocir. 2007;18:23-9.
13. Cappabianca P, de Divitiis E. Endoscopy and transsphenoidal surgery. Neurosurgery. 2004;54(5):1043-50.
14. Castro LC, Martín SE, Bulacio S, Dichko D, Silvano L, Sobrero G, et al. Síndrome de interrupción del tallo pituitario. Relaciones clínicas, bioquímicas y neurorradiológicas. Rev. Argent. Endocrinol. Metab. 2017;54(4):151-9.
15. Cebula H, Kurbanov A, Zimmer LA, Poczos P, Leach JL, De Battista JC, et al. Endoscopic, endonasal variability in the anatomy of the internal carotid artery. World Neurosurg. 2014;82(6):E759-64.
16. Chanson P, Bertherat J, Beckers A, Bihan H, Brue T, Caron P, et al. French consensus on the management of acromegaly. Ann. Endocrinol. 2009;70(2):92-106.
17. Chanson P, Raverot G, Castinetti F, Cortet-Rudelli C, Galland F, Salenave S, et al. Management of clinically non-functioning pituitary adenoma. Ann. Endocrinol. 2015;76(3):239-47.
18. Chanson P, Salenave S, Kamenicky P. Chapter 14 – Acromegaly. Handb. Clin. Neurol. 2014;124:197-219.
19. Colao A. The prolactinoma. Best Pract. Res. Clin. Endocrinol. Metab. 2009;23(5):575-96.
20. Cooper O, Melmed S. Subclinical hyperfunctioning pituitary adenomas: The silent tumors. Best Pract. Res. Clin. Endocrinol. Metab. 2012;26(4):447-60.
21. Cordido F, García Arnés JA, Marazuela Aspiroz M, Torres Vela E. Practical guidelines for diagnosis and treatment of acromegaly. Endocrinol. y Nutr. English Ed. 2013;60(8):457.e1-15.
22. Cossu G, Daniel RT, Pierzchala K, Berhouma M, Pitteloud N, Lamine F, et al. Thyrotropin-secreting pituitary adenomas: a systematic review and meta-analysis of postoperative outcomes and management. Pituitary. 2019;22(1):79-88.
23. Fernández Molina F, Mercapide C. Referencias anatómicas óseas en tomografía computada para el abordaje transesfenoidal a la base de cráneo. Rev. Argentina Neurocir. 2018;32:189-99.
24. Fleseriu M, Hashim IA, Karavitaki N, Melmed S, Murad MH, Salvatori R, et al. Hormonal replacement in hypopituitarism in adults: An endocrine society clinical practice guideline. J. Clin. Endocrinol. Metab. 2016;101(11):3888-921.
25. Freda P, Beckers A, Katznelson L, Molitch M, Montori V, Post KD, et al. Pituitary incidentaloma: An endocrine society clinical practice guideline. J. Clin. Endocrinol. Metab. 2011;96(4):894-904.
26. Giustina A, Barkan A, Casanueva FF, Cavagnini F, Frohman L, Ho K, et al. Criteria for cure of acromegaly: A consensus statement. J. Clin. Endocrinol. Metab. 2000;85(2):526-9.
27. Goleman D, Boyatzis R, Mckee A. The role of inferior petrosal sinus sampling in ACTH-dependent Cushing’s syndrome: review and joint opinion statement by members of the Italian Society for Endocrinology, Italian Society for Neurosurgery, and Italian Society for Neuroradiology. J. Chem. Inf. Model. 2019;53(9):1689-99.
28. Hadad G, Bassagasteguy L, Carrau RL, Mataza JC, Kassam A, Snyderman CH, et al. A novel reconstructive technique after endoscopic expanded endonasal approaches: Vascular pedicle nasoseptal flap. Laryngoscope. 2006;116(10):1882-6.
29. Hammer G, Radberg C. The sphenoidal sinus: An anatomical and roentgenologic study with reference to transsphenoid hypophysectomy. Acta radiol. 1961;Original S(6):401-22.
30. Hardy J. Transphenoidal microsurgery of the normal and pathological pituitary. Clin. Neurosurg. 1969;16:185-217.
31. Ho RW, Huang HM, Ho JT. The influence of pituitary adenoma size on vision and visual outcomes after trans-sphenoidal adenectomy: A report of 78 cases. J. Korean Neurosurg. Soc. 2015;57(1):23-31.
32. Karavitaki N, Thanabalasingham G, Shore HCA, Trifanescu R, Ansorge O, Meston N, et al. Do the limits of serum prolactin in disconnection hyperprolactinaemia need re-definition? A study of 226 patients with histologically verified non-functioning pituitary macroadenoma. Clin. Endocrinol. 2006;65(4):524-9.
33. Katznelson L, Laws ER, Melmed S, Molitch ME, Murad MH, Utz A, et al. Acromegaly: An endocrine society clinical practice guideline. J. Clin. Endocrinol. Metab. 2014;99(11):3933-51.
34. Knosp E, Steiner E, Kitz K, Matula C. Pituitary adenomas with invasion of the cavernous sinus space: A magnetic resonance imaging classification compared with surgical findings. Neurosurgery. 1993;33(4):610-8.
35. Lee IH, Miller NR, Zan E, Tavares F, Blitz AM, Sung H, et al. Visual defects in patients with pituitary adenomas: The myth of bitemporal hemianopsia. Am. J. Roentgenol. 2015;205(5):W512-8.
36. Liu C, Lo JC, Dowd CF, Wilson CB, Kunwar S, Aron DC, et al. Cavernous and inferior petrosal sinus sampling in the evaluation of ACTH-dependent Cushing’s syndrome. Clin. Endocrinol. 2004;61(4):478-86.
37. Lugo G, Pena L, Cordido F. Clinical manifestations and diagnosis of acromegaly. Int. J. Endocrinol. 2012;2012:1-10.
38. Manuylova E, Calvi LM aria, Vates GE, Hastings C, Shafiq I. Morning serum cortisol level after transsphenoidal surgery for pituitary adenoma predicts hypothalamic-pituitary-adrenal function despite intraoperative dexamethasone use. Endocr. Pract. 2015;21(8):897-902.
39. Melmed S, Colao A, Barkan A, Molitch M, Grossman AB, Kleinberg D, et al. Guidelines for acromegaly management: An update. Jour. of Clinical Endocr. and Metab. 2009;94:1509-17.
40. Mitsuhashi Y, Nishio A, Kawahara S, Ichinose T, Yamauchi S, Naruse H, et al. Morphologic evaluation of the caudal end of the inferior petrosal sinus using 3D rotational venography. Am. J. Neuroradiol. 2007;28(6):1179-84.
41. Mohr G, Hardy J, Comtois R, Beauregard H. Surgical Management of Giant Pituitary Adenomas. Can. J. Neurol. Sci. / J. Can. des Sci. Neurol. 1990;17(1):62-6.
42. Molitch ME. Diagnosis and treatment of pituitary adenomas: A review. JAMA - J. Am. Med. Assoc. 2017;317(5):516-24.
43. Nazato DM, Abucham J. Diagnosis and treatment of TSH-secreting adenomas: review of a longtime experience in a reference center. J. Endocrinol. Invest. 2018;41(4):447-54.
44. Nieman LK, Biller BMK, Findling JW, Newell-Price J, Savage MO, Stewart PM, et al. The diagnosis of cushing’s syndrome: An endocrine society clinical practice guideline. J. Clin. Endocrinol. Metab. 2008;93(5):1526-40.
45. Nishioka H, Inoshita N. New WHO classification of pituitary adenomas (4th edition): assessment of pituitary transcription factors and the prognostic histological factors. Brain Tumor Pathol. 2018;35(2):57-61.
46. Ostrom QT, Gittleman H, Farah P, Ondracek A, Chen Y, Wolinsky Y, et al. CBTRUS statistical report: Primary brain and central nervous system tumors diagnosed in the United States in 2006-2010. Neuro. Oncol. 2013;15.
47. Pecoraro NC, Heiferman DM, Martin B, Li D, Johans SJ, Patel CR, et al. Lower-dose perioperative steroid protocol during endoscopic endonasal pituitary adenoma resection. Surg. Neurol. Int. 2019;10(52):52.
48. Pecori Giraldi F, Pagliardini L, Cassarino MF, Losa M, Lasio G, Cavagnini F. Responses to corticotrophin-releasing hormone and dexamethasone in a large series of human adrenocorticotrophic hormone-secreting pituitary adenomas in vitro reveal manifold corticotroph tumoural phenotypes. J. Neuroendocrinol. 2011;23(12):1214-21.
49. Penn D, Burke W, Laws E. Management of non-functioning pituitary adenomas: surgery. Pituitary. 2018;21(2):145-53.
50. Pivonello R, Isidori AM, De Martino MC, Newell-Price J, Biller BMK, Colao A. Complications of Cushing’s syndrome: state of the art. Lancet Diabetes Endocrinol. 2016;4(7):611-29.
51. Prete A, Corsello S, Salvatori R. Current best practice in the management of patients after pituitary surgery. Ther. Adv. Endocrinol. Metab. 2017;8(3):33-48.
52. Rajasekaran S, Vanderpump M, Baldeweg S, Drake W, Reddy N, Lanyon M, et al. UK guidelines for the management of pituitary apoplexy Pituitary Apoplexy Guidelines Development Group: May 2010. Clin. Endocrinol. (Oxf). 2011;74(1):9-20.
53. Santos S, Santos E, Gaztambide S, Salvador J. Diagnóstico y diagnóstico diferencial del síndrome de Cushing. Endocrinol. y Nutr. 2009;56(2):71-84.
54. Solari D, Pivonello R, Caggiano C, Guadagno E, Chiaramonte C, Miccoli G, et al. Pituitary adenomas: what are the key features? What are the current treatments? Where is the future taking us? World Neurosurg. 2019;127:695-709.
55. Solari D, Zenga F, Angileri FF, Barbanera A, Berlucchi S, Bernucci C, et al. A survey on pituitary surgery in Italy. World Neurosurg. 2019;123:e440-9.
56. Tomycz ND, Horowitz MB. Inferior petrosal sinus sampling in the diagnosis of sellar neuropathology. Neurosurg. Clin. N. Am. 2009;20(3):361-7.
57. Tortora F, Negro A, Grasso LFS, Colao A, Pivonello R, Splendiani A, et al. Pituitary magnetic resonance imaging predictive role in the therapeutic response of growth hormone-secreting pituitary adenomas. Gland Surg. 2019;8(3):150-8.
58. Vaezi A, Cardenas E, Pinheiro-Neto C, Paluzzi A, Branstetter BF, Gardner PA, et al. Classification of sphenoid sinus pneumatization: Relevance for endoscopic skull base surgery. Laryngoscope. 2015;125(3):577-81.
59. Villalonga JF, Pilonieta M, Revuelta Barbero JM, Carrau RL, Prevedello DM. Pituitary adenoma concomitant with Chiari I Malformation: case report and literature review. World Neurosurg. 2019;129:45-8.
60. Villalonga JF, Ries-Centeno T, Sáenz A, Solari D, Cervio A, Campero A. The mixed sellar barrier: A new subtype of this novel concept. World Neurosurg. 2019;132:5-13.
61. Wade AN, Baccon J, Grady MS, Judy KD, O’Rourke DM, Snyder PJ. Clinically silent somatotroph adenomas are common. Eur. J. Endocrinol. 2011;165(1):39-44.
62. Wildemberg LE, Glezer A, Bronstein MD, Gadelha MR. Apoplexy in nonfunctioning pituitary adenomas. Pituitary. 2018;21(2):138-44.
63. Wong A, Eloy JA, Couldwell WT, Liu JK. Update on prolactinomas. Part 1: Clinical manifestations and diagnostic challenges. J. Clin. Neurosci. 2015;22(10):1562-7.
64. Woodmansee WW, Carmichael J, Kelly D, Katznelson L. American association of clinical endocrinologists and american college of endocrinology disease state clinical review: Postoperative management following pituitary surgery. Endocr. Pract. 2015;21(7):832-8.
65. Yasuda A, Campero A, Martins C, Rhoton AL, De Oliveira E, Ribas GC. Anatomy and approaches to the cavernous sinus. Neurosurgery. 2008;62(6):1240-63.
66. Yasuda A, Campero A, Martins C, Rhoton AL, Ribas GC. The medial wall of the cavernous sinus: Microsurgical anatomy. Neurosurgery. 2004;55(1):179-89.
Los autores nos ofrecen una comunicación con formato de Monografía de tipo Compilativa (no se incluyen elementos discusivos ni conclusivos) acerca del Manejo Preoperatorio de los Adenomas Hipofisarios, determinando en su título el público destinatario como al residente de neurocirugía.
El texto es de carácter expositivo - enunciativo, desarrollándose su presentación de forma ordenada y clara.
En relación con su contenido, luego de una Introducción somera, se exponen las principales apreciaciones sobre las Manifestaciones Clínicas tanto de adenomas funcionantes como no funcionantes, y de situaciones especiales como la apoplejía; incluyendo la evaluación visual e interpretación de la campimetría visual computada. Asimismo se presenta la nueva clasificación de la WHO. Posteriormente se plantean los principales tópicos de la evaluación endocrinológica y se realizan consideraciones a la hora de interpretar sus resultados.
A continuación se analiza la Evaluación Imageneológica por IRM incluyendo la clasificación de Knosp y la clasificación de extensión supraselar; como así también la importancia de la tomografía computada en el planeamiento quirúrgico.
Finalmente se abordan los criterios de Indicación Quirúrgica de adenomas funcionantes, adenomas no funcionantes y apoplejía tumoral hipofisaria de forma adecuada.
La mayor fortaleza de la presente comunicación es el sentido práctico de su enfoque, además de un lenguaje simple y directo; que compatibiliza con su público destinatario.
Agradecemos a los autores, por la elaboración y entrega de este reporte.
Claudio Centurión.
Sanatorio Aconcagua.
Clínica Vélez Sársfield.
Córdoba.
Se trata de un trabajo que describe claramente el manejo preoperatorio de los adenomas de hipófisis. El trabajo es muy completo y detallado en todos los tipos de adenomas, su presentación clínica, clasificaciones histológicas y de crecimiento.
Se trata de un verdadero capítulo de un libro sobre adenomas con todo lo que el neurocirujano tiene que saber para estudiar e indicar la cirugía en forma correcta en este grupo de pacientes.
La gran cantidad de fotos ilustran claramente lo que se describe.
Debido a la baja incidencia en pacientes con tumores de hipófisis este artículo resulta muy importante en la formación de los jóvenes neurocirujanos.
Pablo Ajler
Jefe de Sección de Cirugía de Base de Cráneo
Hospital Italiano de Buenos Aires