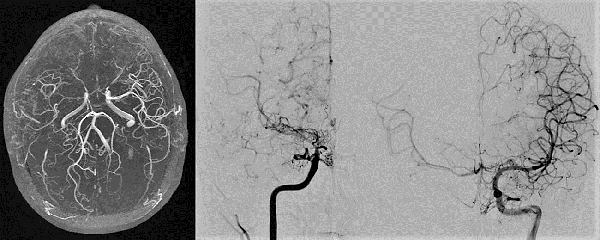
Fig. 1 Caso clínico #1. ARM y ADC preoperatoria, obsérvese la estenosis progresiva de la arteria carótida supraclinoidea derecha con ausencia del origen de las arterias cerebral anterior y media. Corresponde a un grado 3 de Suzuki
Revascularizacion cerebral en el moyamoya del adulto
Ruben Mormandi, Andrés E. Cervio y Santiago G. Condomí Alcorta
Departamento de neurocirugía del Instituto Fleni, Buenos Aires, Argentina.
RESUMEN
Introducción: el Moyamoya (MM) es una enfermedad crónica esteno-oclusiva de los vasos arteriales intracraneanos asociado al desarrollo secundario de arteriolas dilatadas en la base del cerebro. La historia natural de la enfermedad predispone a infartos y/o hemorragias cerebrales. El objetivo del presente trabajo es mostrar nuestra experiencia en el manejo quirúrgico del MM del adulto.
Material y método: se realizó una revisión retrospectiva de 11 pacientes adultos con diagnóstico de MM tratados entre mayo 2014 y mayo 2020. Se analizaron las historias clínicas, estudios diagnósticos, protocolos y videos operatorios. En el preoperatorio se utilizó la escala angiográfica de Suzuki y para la valoración clínica pre y postoperatoria la escala de Rankin modificada.
Resultados: se operaron 11 pacientes (8 femeninos), 9 son portadores de EMM y 2 con SMM secundario a NF1 y enfermedad de Hashimoto. Se realizaron 16 procedimientos de revascularización en 11 pacientes (en 5 pacientes la revascularización cerebral fue bilateral), 12 fueron combinados (bpTS más EDMS) y en 4 sólo sinangiosis tipo EDAMS.
El aumento del flujo sanguíneo cerebral se constató en todos los casos mediante ADC luego de los 6 meses de la cirugía. La permeabilidad del bpTS se comprobó en 10 de 12 bpTS (83.3 %) y la revascularización de la sinangiosis fue muy buena en todos los pacientes. El 82 % de los pacientes mejoraron un punto o más en la escala de Rankin y un paciente presentó un infarto frontal en TAC postoperatoria sin repercusión clínica.
Conclusiones: la evolución natural de la enfermedad conduce al deterioro neurológico por ACV isquémico y/o hemorrágico. En nuestra experiencia, la mejor opción terapéutica en el adulto es la revascularización cerebral combinada porque disminuye la incidencia de ACV con resultados favorables y escasa morbilidad.
Palabras claves: moyamoya, revascularización cerebral, bypass temporosilviano, sinangiosis
Abreviaturas: MM: moyamoya EMM: enfermedad de moyamoya SMM: síndrome de moyamoya RMN: resonancia magnética nuclear ARM: angio resonancia magnética ADC: angiografía digital cerebral bpTS: bypass temporosilviano EDMS: encéfalo duro mio sinangiosis EDAMS: encéfalo duro arterio mio sinangiosis EGPS: encéfalo galeo periostio sinangiosis ACV: accidente cerebrovascular TAC: tomografía axial computada NF1: neurofibromatosis tipo 1
ABSTRACT
Introduction: Moyamoya is a chronic steno-occlusive disease of the intracranial vessels associated to the secondary development of dilated arterioles at the base of the brain. The natural history of the disease predisposes to cerebral infarcts and/or hemorrhages. The objective of this paper is to show our experience and surgical management of adult moyamoya.
Materials and Methods: retrospective review of 11 adult patients with moyamoya treated from May 2014 to May 2020 was performed. Clinical charts, neuroimaging studies, operative records and surgical videos were analyzed. The Suzuki scale was used as a preoperative score, and the modified Rankin scale was used for pre and postoperative clinical assessment.
Results: Eleven patients (8 females) were operated at our Institution: 9 are MMD and 2 MMS secondary to NF1 and Hashimoto disease. We performed 16 cerebral revascularizations in 11 patients (in 5 patients the
cerebral revascularization was bilateral), 12 were combined (STA-MCA bypass plus EDMS) and in only 4 EDAMS synangiosis was done.
The increase in cerebral blood flow was verified in all cases by follow-up DSA at 6 months. The STA-MCA bypass permeability was verified in 10 of 12 cases (83.3%) and the revascularization by synangiosis was demonstrated in all patients. Clinical follow-up showed that 82 % of the patients improved one point or more on the modified Rankin scale and one patient presented a frontal infarction on postoperative CT without clinical worsening.
Conclusions: The natural course of the disease leads to neurological deterioration due to ischemic and hemorrhagic stroke. According to our experience, the best therapeutic option in adults is combined cerebral revascularization because it decreases the incidence of stroke with good results and low morbidity.
Key words: moyamoya, cerebral revascularization, STA-MCA bypass, synangiosis
Abbreviations: MM: moyamoya MMD: moyamoya disease MMS: moyamoya syndrome NMR: nuclear magnetic resonance MRA: magnetic resonance angio DSA: digital subtraction angiography EDMS: Encephaloduromyosynangiosis EDAMS: Encephaloduroarteriomyosynangiosis EGPS: Encephalogaleoperyostiosynangiosis STA-MCA bypass: superficial temporal artery-middle cerebral artery bypass CT scan: computer tomography NF1: neurofibromatosis type 1
INTRODUCCIÓN
El Moyamoya (MM) es una enfermedad crónica y de causa desconocida caracterizada por el hallazgo angiográfico de estenosis u oclusión de la porción terminal de la arteria carótida interna en forma bilateral y asimétrica, asociado al anormal desarrollo secundario de vasos en la base del cerebro. Estos vasos dilatados también llamados vasos de MM son arteriolas hiper-desarrolladas que en la angiografía digital dan la imagen característica de “bocanada de humo” o “moyamoya” en japonés, término acuñado por Suzuki y Takaku en 19691. Esta definición de la enfermedad Moyamoya (EMM) fue establecida por el “Comité de Investigación de Enfermedades Oclusivas del Círculo de Willis” del Ministerio de Salud Pública y Bienestar Social de Japón y es generalmente aceptada en todo el mundo. También es sabido que la EMM se asocia o es secundaria a otras enfermedades como anemia perniciosa, enfermedades autoinmunes, síndrome de Down, ateroesclerosis, traumatismo de cráneo, meningitis, neoplasias endocraneanas, von Recklinghausen, irradiación craneana, etc. En estos casos se lo denomina síndrome de Moyamoya (SMM) o enfermedad de quasi-moyamoya; también existen casos de MM angiográfico en pacientes oligo o asintomáticos probablemente relacionado a estadios iniciales de la enfermedad 2.
La mayor información y experiencia acerca de la EMM provienen del este asiático; en especial, Japón, Corea y China. En Japón la prevalencia es de 3.16 % y la tasa de incidencia es de 0.35 cada 100.000 personas por año, la relación mujer-hombre es de 1.8:1. El mayor pico de distribución en edad es de 10 a 14 años, con un segundo pico de presentación (de menor intensidad) a partir de los 40 años3.
El Ministerio de Salud Pública y Bienestar Social de Japón estableció en 1995 la presentación clínica en 4 tipos: isquémico, hemorrágico, epiléptico y “otros”; la forma isquémica es más frecuente en niños, en cambio la forma hemorrágica es más frecuente en adultos. La progresión de la enfermedad conlleva a un estado de isquemia cerebral crónica que predispone a diferentes tipos de ACV isquémicos y deterioro cognitivo; la rotura de los vasos dilatados de MM y/o sus microaneurismas asociados son los responsables de las formas hemorrágicas.
La revascularización cerebral directa es el tratamiento de elección en adultos y comprende al bypass temporo-silviano (bpTS). Además de mejorar la isquemia cerebral crónica reduce el riesgo de sangrado y resangrado en las formas hemorrágicas de MM. Esto último quedó demostrado en el Japan Adult Moyamoya (JAM) Trial: ensayo multicéntrico randomizado en el que compararon tratamiento conservador versus cirugía en pacientes con MM hemorrágico4.
La revascularización cerebral indirecta se basa en el poder de angiogénesis o sinangiosis que tienen algunos tejidos como la galea-periostio, el músculo, la pared de las arterias o la capa externa de la duramadre sobre la superficie pial del cerebro. Así tendremos los diferentes tipos de sinangiosis: encéfalo-miosinangiosis (EMS), encéfalo-galeo-periostiosinangiosis (EGPS), encéfalo-arteriosinangiosis (EAS), encéfalo-durosinangiosis (EDS) o sus combinaciones como encéfalo-duro-arterio-sinangiosis (EDAS), encéfalo-duro-arterio-miosinangiosis (EDAMS), etc. La revascularización indirecta está indicada como único tratamiento cuando los vasos donante y receptor son pequeños como ocurre en la población pediátrica. Por último, el tratamiento combinado comprende a ambos tipos de revascularización, aumentando así la posibilidad de mejorar el flujo sanguíneo cerebral aportado desde la arteria carótida externa.
MATERIAL Y MÉTODO
Se realizó una revisión retrospectiva de todas las historias clínicas, estudios por imágenes y videos operatorios de los pacientes portadores de enfermedad esteno-oclusiva cerebral compatible con Moyamoya intervenidos quirúrgicamente mediante revascularización cerebral en nuestra institución durante el período comprendido entre mayo de 2014 y mayo de 2020. Se recolectaron y analizaron los datos demográficos, antecedentes personales con factores de riesgo vascular (diabetes, hipertensión arterial y dislipidemia), presentación clínica, evolución postoperatoria y seguimiento clínico diferido (Tabla 1).
La evaluación radiológica en todos los casos incluyó resonancia magnética (RM) con secuencias T1, T2, SWI, Difusión, Flair, Gre y con contraste. Angio resonancia magnética (ARM) con especial foco en los tiempos arteriales y la angiografía digital cerebral (ADC) analizando los vasos intra y extracraneanos (desde la arteria carótida primitiva, carótida interna y externa con especial interés en la arteria temporal superficial como arteria donante para el bypass) categorizando en grados a los pacientes según la escala de Suzuki (Tabla 2). Los grados 1,2 y 3 de Suzuki se basan en el grado de estenosis carotídea, desarrollo de los vasos de MM y ausencia de aporte desde la carótida externa vía las arterias meníngeas, etmoidales y del cuero cabelludo. Los grados 4, 5, y 6 de Suzuki se basan en la reducción y ausencia de las arterias endocraneanas principales y los vasos de MM, asociado a la compensación de flujo de carótida externa a interna por el mayor desarrollo de anastomosis leptomeníngeas.
Se analizaron los protocolos operatorios con especial interés en la técnica quirúrgica y el tipo de revascularización cerebral (directo, indirecto o combinado). La evolución funcional postoperatoria se comparó con la clínica preoperatoria mediante la escala de Rankin modificada (Tabla 3). Los resultados de la escala de Rankin modificada de 0-1 fueron considerados como buena evolución, resultados de 2-3 como regulares y los de 4-5 y 6 como malos. El seguimiento promedio fue de 46 meses con un rango de 13 a 74 meses. Todos los pacientes fueron seguidos en forma semestral con RMN y ARM. En todos los casos, se realizó ADC a partir del 6º mes postoperatorio para controlar la permeabilidad del bpTS y el resultado de la sinangiosis.
TABLA 1. LISTADO DE LOS 11 PACIENTES Y LAS 16 REVASCULARIZACIONES
| NA | Edad | Sexo | Lado | Tipo de MM | Grado de Suzuki | Forma clínica | Clínica preop | Tipo de cirugía | Complicaciones | Sinangiosis | By pass permeable | Seguimiento (meses) | mRS pre | mRS post |
| LD | 51 | F | Izq | EMM | 4 | Isquémico | Deterioro cognitivo | BTS + EDMS Izq + EGPS bifrontal | Infarto frontopolar | SI | SI | 74 | 2 | 2 |
| NY | 23 | F | Izq | SMM, NF1 | 4 | Isquémico | hemiparesia | BTS + EDMS Izq | SI | NO | 73 | 1 | 0 | |
| PR | 20 | M | Der | EMM | 3 | Isquémico | Cefalea | BTS + EDMS Der | SI | SI | 72 | 1 | 0 | |
| MF | 25 | F | Der | EMM | 4 | Isquémico | Hemiparesia | BTS + EDMS Der + EGPS bifrontal | SI | SI | 68 | 2 | 1 | |
| NY | 25 | F | Der | SMM, NF1 | 4 | Isquémico | Hemiparesia | EDAMS Der | SI | ///// | 57 | 1 | 0 | |
| GM | 27 | F | Der | SMM, Hashimoto | 3 | Isquémico | hemiparesia | BTS + EDMS Der | SI | SI | 55 | 1 | 0 | |
| VH | 56 | M | Izq | EMM | 4 | Isquémico | Cefalea y Acúfenos | BTS + EDMS Izq + EGPS bifrontal | SI | NO | 55 | 1 | 0 | |
| MF | 26 | F | Izq | EMM | 4 | Isquémico | hemiparesia | BTS + EDMS Izq | SI | SI | 49 | 1 | 0 | |
| GM | 28 | F | Izq | SMM, Hashimoto | 3 | Isquémico | hemiparesia | BTS + EDMS Izq | SI | SI | 46 | 1 | 0 | |
| MK | 30 | F | Der | EMM, Koreana | 4 | Isquémico | hemiparesia | BTS + EDMS Der | SI | SI | 44 | 1 | 0 | |
| MG | 18 | M | Izq | EMM | 4 | Isquémico | disartria | EDAMS Der | SI | ///// | 44 | 1 | 0 | |
| JM | 19 | F | Izq | EMM | 3 | Isquémico | Parafasias y paresia braquial D | EDAMS Izq | SI | ///// | 32 | 1 | 0 | |
| MG | 18 | M | Der | EMM | 3 | Isquémico | disartria | EDAMS Izq | SI | ///// | 31 | 1 | 0 | |
| VH | 59 | M | Der | EMM | 3 | Isquémico | Cefalea y Acúfenos | BTS + EDMS Der | SI | SI | 15 | 1 | 0 | |
| PM | 42 | F | Der | EMM | 4 | Isquémico | Cefalea | BTS + EDMS Der | SI | SI | 15 | 1 | 1 | |
| MPV | 44 | F | Der | EMM | 3 | Isquémico | Hemiparesia Izq | TS + EDMS Der | SI | SI | 13 | 1 | 0 | |
Tabla 2. ESCALA ANGIOGRÁFICA DE SUZUKI
Grado |
Descripción |
1 |
Estenosis de la arteria carótida interna intracraneana |
2 |
Inicialización de los vasos de MM |
3 |
Mayor desarrollo de los vasos de MM y desaparición (generalmente proximal) de las arterias cerebral anterior y media |
4 |
Disminución de los vasos de MM, desaparición de la arteria cerebral posterior y presencia de anastomosis leptomeníngeas (de carótida externa a arterias cerebrales) |
5 |
Mayor reducción de los vasos de MM, ausencia de las arterias cerebrales y sus primeras ramas, mayor desarrollo de las anastomosis provenientes de carótida externa |
6 |
Ausencia de los vasos de MM y todo el flujo cerebral proviene de la arteria carótida externa |
TABLA 3. ESCALA MODIFICADA DE RANKIN
0 |
Asintomático |
1 |
Sin discapacidad significativa a pesar de los síntomas. Es capaz de llevar a cabo todas las tareas y actividades habituales |
2 |
Discapacidad leve. Es incapaz de llevar a cabo todas las actividades habituales, pero es auto válido |
3 |
Discapacidad moderada. Requiere ayuda, pero puede caminar por motus propio |
4 |
Discapacidad moderadamente a severa. No puede caminar sin ayuda, no puede atender sus necesidades fisiológicas sin ayuda |
5 |
Discapacidad severa. Postrado en la cama, incontinente. Requiere atención de enfermería permanente |
6 |
Muerte |
RESULTADOS
Durante el período comprendido entre mayo de 2014 y mayo de 2020, fueron realizadas 16 cirugías de revascularización cerebral en 11 pacientes portadores de MM en nuestra institución (en 5 pacientes la revascularización fue bilateral). La muestra incluyó 8 pacientes femeninos (83%) y 3 pacientes masculinos (27%), 9 (82%) pacientes presentaban la EMM y solo 2 (18%) pacientes el SMM asociados a Neurofibromatosis tipo 1 y Tiroiditis de Hashimoto. La edad media fue de 32 años con un rango de 18 a 59 al momento de la cirugía (Tabla 1). Todos los pacientes presentaron la forma clínica de tipo “Isquémico” y el diagnóstico radiológico de MM fue realizado con RMN, ARM y ADC en todos los casos. De acuerdo con la escala angiográfica de Suzuki hubo un predominio de grados 3 y 4. En 6 pacientes (54%) se realizó revascularización cerebral de un solo lado y en 5 pacientes (46%) fue bilateral, totalizando 16 procedimientos de revascularización. De las 16 revascularizaciones, 12 (75%) fueron combinados (directos o bypass temporo-silviano e indirecto o sinangiosis), y en 4 (25%) se realizó revascularización indirecta solamente debido al poco desarrollo de la arteria temporal superficial (aTS). El bypass temporo-silviano (bpTS) se realizó entre la arteria temporal superficial con una rama silviana de M3 o M4, el tiempo promedio de clipado transitorio de la M3 o M4 durante la anastomosis fue de 40 a 50 minutos; fue controlado con Doppler intraoperatorio cualitativo (Mizuho Medical Innovation®) y potenciales evocados. En todos los pacientes se realizó revascularización indirecta del tipo EDMS (inversión de la duramadre y aposición del músculo temporal). En los 4 casos en los que no se pudo efectuar el bpTS se agregó al EDMS una encéfalo-arteriosinangiosis con la arteria temporal superficial quedando como EDAMS; adicionalmente en 3 pacientes (27 %) se realizó encéfalo-galeo-periostiosinangiosis bifrontal (EGPS) para acrecentar el flujo en el territorio de las arterias cerebrales anteriores.
El aumento del flujo sanguíneo cerebral se verificó en todos los casos mediante ADC luego de los 6 meses de la cirugía. La permeabilidad del bpTS se comprobó en 10 de 12 bpTS (83.3 %) y la revascularización de la sinangiosis fue muy buena en todos los pacientes. En un solo caso se comprobó un infarto cerebral postoperatorio en la TAC de control (ramo frontal anterior) sin repercusión clínica. En solo 2 casos, no se observaron cambios en la escala modificada de Rankin, mientras que en el resto (81.8%) se observó la mejoría en un punto de la misma escala luego de la revascularización.
CASOS ILUSTRATIVOS
Caso clínico #1: PR masculino de 20 años sin antecedentes clínicos, estudiado por cefaleas de varios meses de evolución. La RMN no presenta lesiones y la ARM evidencia una disminución del flujo de la arteria cerebral media derecha. La ADC muestra la estenosis progresiva de la arteria carótida interna derecha supraclinoidea, ausencia de opacificación del origen de la arteria cerebral media y anterior, presencia de vasos de MM con escasa circulación colateral desde carótida interna izquierda a través de la comunicante anterior; corresponde a un grado 3 de Suzuki (Fig. 1). Se realizó una revascularización cerebral combinada: un bpTS más EDMS derecho, la evolución postoperatoria fue sin complicaciones y la ADC diferida muestra una buena perfusión cerebral a través del bypass y la sinangiosis (Fig. 2). El control clínico a 4 años es favorable y las imágenes de RMN y RMA evidencian ausencia de nuevas lesiones isquémicas y adecuada revascularización.

Fig. 1 Caso clínico #1. ARM y ADC preoperatoria, obsérvese la estenosis progresiva de la arteria carótida supraclinoidea derecha con ausencia del origen de las arterias cerebral anterior y media. Corresponde a un grado 3 de Suzuki

Fig. 2 Caso clínico #1. ADC postoperatoria en frente (izquierda) y perfil ampliado (derecha), bp TS derecho con un buen calibre en la arteria temporal superficial (aTS) y muy buena perfusión cerebral
Caso clínico # 2: LD femenino de 51 años con antecedente de tabaquismo e hipertensión arterial, estudiada por deterioro cognitivo de varios meses de evolución. La RMN y ARM evidencia atrofia de hemisferio cerebral izquierdo con hiperintensidad periventricular y disminución franca del calibre de las arterias cerebral anterior y media izquierda con desarrollo de los vasos de MM (Fig. 3). La ADC muestra el stop de la arteria carótida interna izquierda distal y ausencia del origen de las cerebrales anterior y media, buen desarrollo de los vasos de MM y aporte de vasos meníngeos y etmoidales correspondiente a un grado 4 de Suzuki (Fig. 4). Se realizó una revascularización cerebral combinada: un bpTS izquierdo más EDMS y, para aumentar la perfusión en territorio de ambas arterias cerebrales anteriores, un EGPS bifrontal. En la TAC postoperatoria se evidenció un infarto fronto-polar mesial sin repercusión clínica. La ADC postoperatoria diferida evidencia una buena revascularización en los territorios de las arterias cerebral anterior y media a partir del bpTS y la doble sinangiosis (Fig. 5).

Fig. 3 Caso clínico # 2. RMN y ARM preoperatoria, se evidencia atrofia de hemisferio cerebral izquierdo con hiperintensidad periventricular y disminución franca del calibre de las arterias cerebral anterior y media izquierda con desarrollo de los vasos de MM
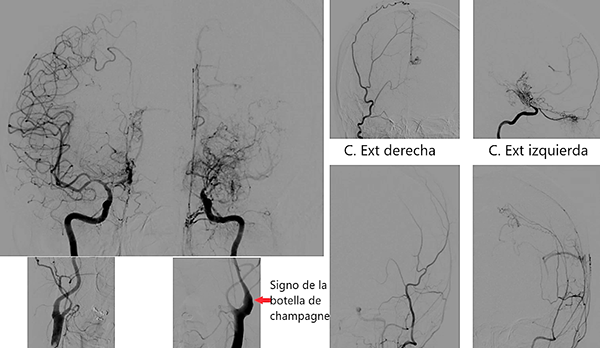
Fig. 4 Caso clínico # 2. ADC preoperatoria con compromiso bilateral de las arterias carótidas supraclinoidea mayor a izquierda, vasos de MM y presencia de anastomosis leptomeníngeas. Nótese el signo de la botella de champagne en el origen de la arteria carótida interna cervical, presente en los MM avanzados. Corresponde a un grado 4 de Suzuki
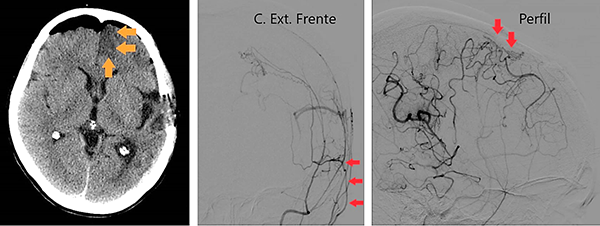
Fig. 5 Caso clínico # 2. Postoperatorio. A la izquierda una TAC con pequeño infarto frontomesial. La imagen del centro es una ADC de frente que muestra el bpTS con muy buena perfusión cerebral. La imagen de la derecha es la ADC de perfil que muestra una buena perfusión cerebral a partir de la EGPS bifrontal
Caso clínico #3 (cirugía bilateral): GM femenino de 27 años, con antecedente de hipotiroidismo secundario a Enfermedad de Hashimoto; consultó por cuadro de parestesias y paresia leve braquial izquierda de más de 6 meses de evolución. La RMN evidencia pequeñas imágenes isquémicas en ambos centros semiovales a predominio derecho; la ARM y ADC muestran la estenosis severa de ambas arterias carótidas internas y ausencia del origen de ambas arterias silvianas con vasos de MM presentes; corresponde a un grado 3 de Suzuki (Fig. 6). Se realizó primero un bpTS derecho más EDMS y, a los 10 meses, otro bpTS más EDMS izquierdo con buena evolución en ambas revascularizaciones. La ADC alejada muestra franca mejoría de la perfusión cerebral bilateral más marcado a la izquierda (Fig. 7 y 8).

Fig. 6 Caso clínico #3. Preoperatorio. A la izquierda, la RMN evidencia pequeñas imágenes isquémicas en ambos centros semiovales mayor a derecha, la ADC muestran la estenosis severa de ambas arterias carótidas internas supraclinoidea y ausencia del origen de ambas arterias silvianas, vasos de MM presentes correspondiente a un grado 3 de Suzuki

Fig. 7 Caso clínico #3. Postoperatorio. ADC lado derecho que muestra buena perfusión cerebral del bpTS (las flechas rojas muestran el curso de la aTS) y la EMDS

Fig. 8 Caso clínico #3. Postoperatorio. ADC lado izquierdo con muy buena perfusión cerebral desde el bpTS (las flechas rojas muestran el curso de la aTS) y la EMDS
DISCUSIÓN
La angiopatía del MM es un proceso gradual, bilateral y asimétrico, caracterizado por una estenosis supraclinoidea progresiva que evoluciona a oclusión de la arteria carótida interna distal y segmentos proximales de las arterias cerebral anterior y media; en los estadios finales compromete además a la arteria cerebral posterior. En respuesta a la isquemia crónica que esta situación genera se desarrollan las arteriolas en la base de cráneo llamados vasos de MM que le dan el nombre a la enfermedad. Clásicamente se habla de EMM cuando es idiopático, SMM cuando se asocia o es secundario a otras patologías como anemia perniciosa, enfermedades autoinmunes, síndrome de Down, ateroesclerosis, traumatismo de cráneo, meningitis, neoplasias endocraneanas, von Recklinghausen, irradiación craneana, etc. Actualmente, se agregan otras formas de la enfermedad como la EMM asintomática, MM familiar, MM unilateral, y la angiopatía MM2, 5. La generalización de estudios no invasivos como la RMN y ARM permiten hacer el diagnóstico precoz de EMM asintomática, formas unilaterales y el MM familiar 6; este último presenta una incidencia del 10% en Japón 7.
En el MM asintomático, el 30% de los pacientes presentan infartos cerebrales silentes o alteraciones angiográficas y se estima una probabilidad de un 3.2% anual de desarrollar déficit neurológico8. En el MM sintomático la tasa anual de ACV isquémico recurrente asciende a 10-13%, con una incidencia estimada de ACV isquémico a 5 años de 40 a 65%, y 82% en las formas bilaterales9-14. El MM tiene un riesgo anual de sangrado del 2 al 7% y una tasa de resangrado de 30 a 60%. La tasa de mortalidad es globalmente alta: ronda el 18% para la primera hemorragia y asciende a 30-80 % en las sucesivas hemorragias9, 15-20
El análisis del árbol genealógico de pacientes con MM familiar revela un patrón autosómico dominante. Mediante análisis genético en diferentes grupos con MM familiar se han identificado por lo menos 5 regiones cromosómicas responsables de la enfermedad de MM. La región primaria se localiza en el cromosoma 17q25.3 y el gen susceptible y relacionado al MM es el llamado RNF213. Este gen se lo encontró mutado en el 95% de los MM familiares en Japón, y en el 73% de los MM no familiares 7, 21, 22, 23. Un número creciente de publicaciones en la literatura avala la posibilidad de que el MM es causado principalmente por la sinergia de factores genéticos y ambientales; es decir, se hereda una susceptibilidad genética primaria y un evento agregado a lo largo de la vida (una infección o inflamación, enfermedad autoinmune, un tumor, traumatismo de cráneo, radioterapia, etc.) puede desencadenar la patología 24.
Las observaciones en anatomía patológica indican que la causa de muerte más frecuente en el MM son las hemorragias cerebrales, en especial en los ganglios de la base, tálamo y tronco sumado al volcado ventricular secundario 25, 26. En cuanto a los infartos cerebrales, son más frecuentes los de pequeño tamaño a nivel de los ganglios de la base, tálamo, cápsula interna y centros semiovales 25, 27. La histopatología de los vasos mayores del círculo de Willis muestra un engrosamiento fibrocelular a nivel de la íntima con la presencia de abundantes células musculares lisas, ondulaciones de la lámina elástica interna y disminución del espesor de la media 27, 28, 29. Los vasos de MM son las arterias perforantes dilatadas originadas en el círculo de Willis: lenticuloestriadas y tálamoperforantes. A la microscopía pueden tener 2 patrones: vasos dilatados de paredes finas (más frecuente en pacientes jóvenes) y vasos estenosados con paredes gruesas 28. En el MM no es infrecuente la presencia de aneurismas cerebrales localizados en las arterias mayores del círculo de Willis (aneurismas verdaderos), y también en los vasos de MM (microaneurismas o pseudoaneurismas). Estos aneurismas son los responsables de la hemorragia subaracnoidea e intraparenquimatosa 30, 31. En nuestra serie no se observaron aneurismas asociados. En el MM puede existir una red de vasos leptomeníngeos con un sentido de circulación de externa a interna. Son la dilatación de vasos preexistentes y no vasos de neoformación y se lo denomina también como MM de la bóveda craneana 32, 33. Por último, el MM puede afectar a las arterias en el cuello y las sistémicas, entre otras las arterias carótidas, pulmonar, coronaria y renal 34, 35. A la estenosis de la arteria carótida interna cervical en su origen se la aprecia con el signo angiográfico de la botella de champagne (ver Fig. 4).
La sintomatología es variada, a veces repetitiva y progresiva, y abarca episodios de cefalea, déficit motor, sensitivo, del habla, epilepsia, trastornos de la conciencia debido a accidente isquémico transitorio (AIT), infartos cerebrales, hemorragia subaracnoidea e intraparenquimatosa. El Ministerio de Salud Pública y Bienestar Social de Japón estableció en 1995 la presentación clínica en 4 tipos: isquémico (63.4%), hemorrágico (21.6%), epiléptico (7.6%) y otros (7.5%). La forma isquémica es más frecuente en niños y está descripta que en los niños pequeños y en situación de hiperventilación (llorar, soplar, infección de la vía respiratoria) puede desencadenar un ACV isquémico debido a que la hiperventilación produce descenso de la PaCO2 y ésta disminuye el flujo sanguíneo cerebral. La forma hemorrágica es más frecuente en adultos con predominio en mujeres, se menciona a la hipertensión arterial y la edad avanzada como coadyuvantes en la hemorragia. En la forma “otros” podemos agrupar a la cefalea, deterioro cognitivo y los trastornos de la conciencia 36, 37. En nuestra serie la totalidad de los pacientes presentaron la forma “Isquémica”, clínicamente 3 consultaron por cefalea, 1 se estudió por deterioro cognitivo y 7 por déficit motor.
Todos nuestros pacientes fueron estudiados con RMN, ARM y ADC de 6 vasos (los 4 vasos endocraneanos más las 2 arterias carótidas externas). La TAC es el estudio inicial en cualquier evento neurológico pudiendo observar hemorragias o, en algunos casos, infartos evolutivos. La mayor sensibilidad y especificidad para el MM la brindan la RMN y ARM de 1.5 Tesla o superior. Permite sospechar MM en casos de imágenes isquémicas uni o bilaterales, imágenes de vacío de flujo en los ganglios de la base, el signo de la hiedra en FLAIR y T1 con contraste realzando los vasos leptomeníngeos en los surcos corticales (MM avanzado). La ARM prácticamente confirma el diagnóstico de MM demostrando la estenosis u oclusión generalmente bilateral de la porción terminal de la arteria carótida interna y las porciones iniciales de las arterias cerebral anterior y media más la visualización de los vasos de MM. En 1997, el Comité de Investigación para la oclusión espontánea del círculo de Willis del Ministerio de Salud Pública y Bienestar Social del Japón estableció que para el diagnóstico de MM son necesarias la RMN y ARM mayor de 1 Tesla, siempre y cuando se observe compromiso bilateral tipo estenosis u oclusión de la porción terminal de la arteria carótida interna y las porciones iniciales de las arterias cerebral anterior y media, asociado al desarrollo anormal de la red de vasos en la base de cráneo; en estos casos la ADC no es estrictamente necesaria para confirmar el diagnóstico 38. Creemos imprescindible la ADC por varios motivos: permite ver la perfusión cerebral en forma dinámica (áreas de hipoflujo, la compensación del flujo proveniente del circuito posterior), la magnitud de los vasos de MM, la existencia de aneurismas asociados y, además, cuantificar la presencia de vasos dilatados meníngeos y etmoidales que son verdaderas anastomosis naturales extra-intracraneanas y ayudan a perfundir al cerebro. Así mismo, permite valorar a la arteria temporal superficial como potencial arteria donante para el bypass TS. Algunos autores miden el diámetro de la arteria donante, si es menor de 0.6-0.8 mm no la consideran apta para el bypass y optan por la revascularización indirecta 39.
El MM es una enfermedad crónica y evolutiva con frecuente progresión de la forma unilateral a bilateral, como así también el ascenso en la escala de Suzuki. La historia natural del MM está delineada en los grados de Suzuki: estenosis y oclusión de la porción terminal de la carótida interna, seguido de la estenosis y oclusión de la porción proximal de las arterias cerebral anterior y media, desarrollo de los vasos de MM, estenosis y oclusión de la arteria cerebral posterior, dilatación de los vasos leptomeníngeos (vasos meníngeos, etmoidales y del scalp) que reemplazarán a todo el flujo sanguíneo cerebral. El estado de hipoperfusión crónica induce primero a los vasos de MM (hiperdilatación de la red de arteriolas lenticuloestriadas y tálamogeniculadas) más el desarrollo de anastomosis piales cortico-corticales entre las arterias cerebrales anterior, media y posterior; y luego induce el desarrollo de las conexiones leptomeníngeas transdurales que persisten durante toda la enfermedad y van a ser el único soporte del flujo sanguíneo cerebral. A este proceso hemodinámico (producto de la enfermedad) de suplencia vascular interna por el sistema de la arteria carótida externa se lo denomina conversión de carótida interna a externa 1, 40.
El objetivo principal del tratamiento es acrecentar el flujo sanguíneo cerebral en los territorios deficitarios desde el sistema de la carótida externa mediante un bypass y/o sinangiosis para lograr disminuir el riesgo de ACV. Además, está demostrado que baja 3 veces el riesgo de hemorragia luego de la revascularización al disminuir la sobrecarga hemodinámica en los vasos dilatados de MM en los ganglios basales 4, 16, 18, 41-7. La revascularización cerebral está indicada en los casos de MM sintomático, pero la tendencia actual es hacerla también en el MM asintomático debido al riesgo de infarto cerebral; en el caso de los niños la conducta es generalmente más agresiva ya que la enfermedad es más progresiva que en adultos 48. La revascularización cerebral puede ser rápida o inmediata mediante la realización de un bypass (lo más frecuente es el bypass temporosilviano y menos frecuente es el de la arteria occipital como donante) o puede ser lenta (meses a años) mediante la revascularización indirecta o encefalosinangiosis basado en el poder de angiogenesis entre la pia-aracnoides cerebral y los diferentes tejidos como la galea-periostio, músculo, duramadre y las paredes de las arterias; la revascularización indirecta no disminuye inicialmente el riesgo de ACV si no hasta luego de varios meses 44, 47, 49. La última evidencia científica sobre el rol del bypass TS en el MM está dada por el metaanálisis de Yawei Yan y col. de 2019 50 quienes concluyen que el bypass TS es superior al tratamiento conservador en prevenir ACV recurrente en el MM del adulto, especialmente la forma hemorrágica; además el bypass está asociado a mejores resultados de revascularización comparado con la sinangiosis. En nuestra serie se realizaron 16 procedimientos de revascularización, de los cuales 12 (75%) fueron combinados (bypass temporo-silviano más sinangiosis), y en 4 (25%) solo se realizó revascularización indirecta debido al poco desarrollo de la arteria temporal superficial. Creemos que la mejor opción terapéutica en adultos es la revascularización cerebral combinada ya que se logra una sinergia en los resultados de las dos técnicas. En el momento de definir la táctica quirúrgica hay que tener en cuenta estos aspectos: 1) el tamaño de la arteria donante, debe tener un diámetro mayor o igual a 0.8 mm; 2) la probable competencia de flujo entre las arterias de M3-4 con la aTS en el punto del bypass, ya que la estenosis leve-moderada de carótida interna distal o silviana puede tener un flujo intenso distal (M3-4), competir con el flujo de la aTS y terminar en la oclusión del bypass 39.
Nuestros pacientes reciben AAS de por vida y no se suspende por la cirugía de revascularización. En los casos de MM bilateral comenzamos la revascularización por el lado más afectado dejando para una segunda instancia diferida la cirugía del otro lado. La revascularización directa es nuestra primera opción y preferimos el bypass temporo-silviano, que complementamos con una EDMS en el mismo abordaje. En caso de imposibilidad de realizar un bypass TS usamos la arteria temporal superficial para un EDAMS. Las cirugías son realizadas bajo anestesia general y estricta estabilidad hemodinámica (inducción, cirugía y postoperatorio) con normocapnia, normotermia o ligera hipotermia evitando la hipotensión arterial en todo momento. Es fundamental el monitoreo neurofisiológico. Además, valoramos el flujo de la arteria donante y receptora con el Doppler vascular intraoperatorio.
Una vez puesto el paciente en posición, se dibuja sobre la piel el trayecto de la arteria temporal superficial con su rama posterior guiado por palpado de pulso y Doppler, y luego se marca la incisión a unos 2 milímetros por detrás del trayecto de la arteria en una longitud de 10 centímetros a partir de 1 centímetro por arriba del arco cigomático (Fig. 9). Se diseca la arteria temporal en un trayecto de unos 9 cm, se incide el musculo temporal en “T” y se realiza la craneotomía. Antes de abrir la duramadre se identifican las arterias meníngeas y se hace la apertura dural respetando dichas arterias; los flaps meníngeos se invaginan de tal manera que la cara externa de la duramadre (capa vascular) quede en contacto con el cerebro permitiendo así la encefalodurosinangiosis. A continuación, se observa la superficie cerebral en busca de la arteria receptora de mayor calibre (ramo M3 o 4), también se la examina con el Doppler y se la diseca liberándola de las adherencias y pequeñas perforantes que van a la superficie cerebral. Se vuelve a la aTS disecada previamente, se colocan 2 clips transitorios a nivel proximal y distal, se secciona a nivel distal y se lava el interior de la arteria con suero heparinizado. Se la presenta sobre la arteria receptora teniendo en cuenta que la aTS debe quedar algo redundante para evitar tensión en la sutura, se libera la adventicia del extremo distal y se secciona en forma de boca de pescado, de modo que la luz coincida con la arteriotomía del vaso receptor y se pinta el borde arterial con azul de metileno. Luego se colocan 2 miniclips temporarios (los de menor fuerza de cierre) en la arteria receptora, se realiza una arteriotomía lineal (la longitud de la arteriotomía debe ser de más del doble que su diámetro), se lava el interior con suero heparinizado, y se pinta el borde de la arteriotomía con azul de metileno. Por último, se procede a hacer una anastomosis termino-lateral usando nylon 10 ceros con aguja redonda de tercio de círculo, la sutura puede ser con puntos separados o continuos; en promedio, el tiempo de clipado transitorio oscila entre 40 y 50 minutos. Una vez liberado el clipado, se revisa la hemostasia de la sutura, se observa el latido del vaso donante y receptor como así también la permeabilidad con el Doppler (Fig. 10). Otra forma de valorar la permeabilidad de la anastomosis es con el microscopio utilizando el verde de Indocianina, pero aún no está autorizado el uso en Argentina. El cierre dural se hace con la capa profunda del músculo temporal. Se lo sutura a todo el borde dural, de manera que el músculo en contacto con la superficie del cerebro resulte en una encefalomiosinangiosis. La plaqueta, en general, se recorta un poco a nivel inferior para no comprimir a la aTS y al músculo temporal; por último, la capa superficial del músculo temporal queda por arriba de la plaqueta.
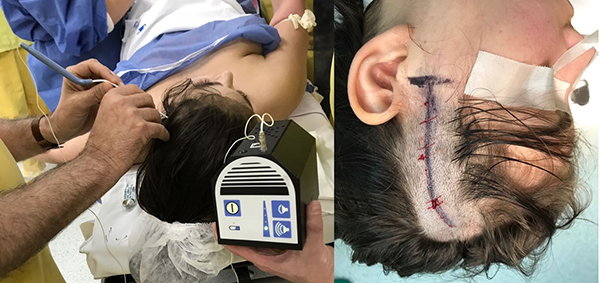
Fig. 9 Localización y demarcación de la aTS mediante Doppler (izq). A la derecha marcación de la piel a unos 2 mm por detrás de la aTS
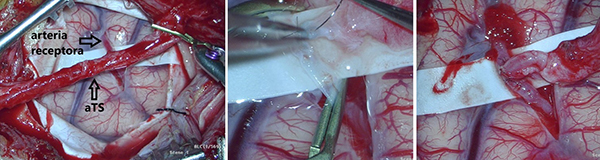
Fig. 10 En la foto de la izquierda se observa a la aTS clipada a punto de ser seccionada sobre la arteria receptora. La foto del centro muestra el inicio del bypass TS con los puntos directrices opuestos. La foto de la derecha muestra el bypass terminado, permeable y sin filtraciones
TABLA 4. COMPARACIÓN DE RESULTADOS EN CASOS DE MM DEL ADULTO CON PRESENTACIÓN "ISQUÉMICA"
Autor, año y referencia |
Nº pacientes |
Tipo de cirugía |
Infartos postoperatorios |
Seguimiento promedio en meses |
Lee, et al (2012) 70 |
39 |
Combinada |
3 |
56 |
Cho, et al (2014) 53 |
77 |
Combinada |
3 |
63 |
Thines, et al (2015) 71 |
12 |
Combinada |
4 |
22 |
Kim, et al (2016) 72 |
301 |
Combinada |
18 |
4 |
Mormandi, et al (2020) |
11 |
Combinada |
1 |
46 |
CONCLUSIONES
El MM es una rara enfermedad crónica esteno-oclusiva de las arterias intracraneanas, desarrollo secundario de vasos en la base de cráneo y apertura de las anastomosis entre los vasos de la arteria carótida externa e interna. El reconocimiento y diagnóstico precoz del MM es fundamental para la prevención de eventos futuros isquémicos y hemorrágicos. El análisis de nuestra serie nos muestra que la revascularización cerebral combinada es una opción terapéutica efectiva para el MM del adulto, con disminución de la probabilidad de nuevos ACV, buenos resultados postoperatorios y escasa morbilidad.
LIMITACIONES
Nuestra serie fue evaluada en forma retrospectiva con todas las imperfecciones inherentes a dicha metodología. El MM es una enfermedad de baja prevalencia en Occidente y el número de pacientes de la serie no fue suficiente como para realizar cálculos estadísticos con resultados significativos.
BIBLIOGRAFÍA
COMENTARIO
En el presente trabajo se presenta un estudio retrospectivo en el tratamiento de revascularización cerebral en pacientes con moya moya analizando una serie de 11 casos. El trabajo nos refresca la actualidad en el diagnóstico y tratamiento de esta patología que, si bien es poco frecuente en nuestro medio, constituye una de las causas de ACV en población pediátrica y adultos jóvenes. La enfermedad de moya moya es a su vez uno de los paradigmas del by pass para aumento de flujo arterial cerebral, mostrando en la casuística del presente trabajo, al igual que en la bibliografía que lo respalda, la utilidad de la misma.
Pablo Rubino
Hospital “El Cruce”. Florencio Varela, Buenos Aires, Argentina.
COMENTARIO
En este trabajo se presenta una serie de casos con enfermedad y síndrome moyamoya tratados mediante diferentes técnicas de revascularización y se realiza una revisión de los principales aspectos teóricos que dictan las guías de manejo de la enfermedad. Este trabajo es importante puesto que se agrega a los escasos reportes acerca de esta enfermedad en población latinoamericana. Llama la atención de que a pesar de ser una población adulta, la totalidad de los casos hayan correspondido a la forma isquémica que es mas frecuente en la población infantil. El estándar de oro en el diagnóstico como se menciona es la ADC; sin embargo, la IRM y ARM se han convertido en buenos substitutos diagnósticos cuando se realiza en equipos de alta resolución. La ADC postoperatoria es imperativa para evaluar el resultado de anastomosis temporosilvianas en términos de permeabilidad de la anastomosis y el grado de revascularización obtenido. Existe cierto grado de controversia acerca de la necesidad de revascularización en pacientes asintomáticos o con presentación isquémica con síntomas leves, ya que de forma inicial muchos de éstos se mantienen asintomáticos con tratamiento conservador. En casos de eventos isquémicos repetidos o eventos hemorrágicos se ha demostrado la utilidad de la revascularización para prevenir nuevos episodios de sangrado. Por otra parte, los aneurismas asociados a moyamoya (que se comportan en su fisiopatología como aneurismas de hiperflujo) son poco frecuentes, aún en centros de referencia1. En nuestra experiencia, la forma más frecuente de presentación en adultos fue la hemorrágica y los resultados de tratamiento (revascularización vs tratamiento médico) favorecieron a los pacientes tratados quirúrgicamente durante el seguimiento 2.
DR. Edgar Nathal
Jefe de Neurocirugía, Instituto Nacional de Neurología y Neurocirugía “Manuel Velasco Suárez” Ciudad de México. Profesor de Neurocirugía Vascular - UNAM